
【题目】在活性炭催化下,用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:
精确称取13.375 g X配成1000 mL溶液,取出10.00 mL溶液,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用20.00 mL 0.20 mol·L1的标准盐酸吸收。蒸氨结束后取下接收瓶,用0.20 mol·L1NaOH标准溶液滴定过剩的HCl,到终点时消耗5.00 mLNaOH溶液。

II、氯的测定:
准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,已知:Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.12×1012。
回答下列问题:
(1)仪器a的名称是_________测定氨前应该对装置进行__________,安全管的作用原理是_____________________________________________________。
(2)NaOH标准溶液应装入___式滴定管,C装置冰盐水的作用是_________。
(3)测定氯的过程中,使用棕色滴定管的原因是____________________;判断滴定终点的方法是___________________________________________________,若终点溶液中c(Ag+)=1.0×105 mol·L1,此时c(CrO42)为______ mol·L1。
(4)13.375 g样品X中氨的物质的量为_____ mol。
(5)经测定,样品X的化学式为Co(NH3)6Cl3,写出制备X的化学方程式:_________________;X的制备过程中,若温度过高X产率下降,原因是___________________。(写一点)
【答案】 分液漏斗 气密性检验 瓶A中的压力过大时,安全管中的液面上升甚至溢出,使A瓶中的压力稳定(合理答案均计分) 碱 降温,使氨气全部被盐酸标准溶液吸收 防止(或减少)硝酸银见光分解 滴入最后一滴标准AgNO3溶液锥形瓶中出现(砖、浅)红色沉淀且半分钟内不消失 1.12×10—2 0.3 2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O 温度过高,H2O2(NH4Cl)分解(或NH3挥发)从而减少反应物造成产率下降(合理答案均计分)
2[Co(NH3)6]Cl3+2H2O 温度过高,H2O2(NH4Cl)分解(或NH3挥发)从而减少反应物造成产率下降(合理答案均计分)
【解析】(1)根据图示,仪器a为分液漏斗,测定氨前应该对装置进行气密性检查,瓶A中的压力过大时,安全管中的液面上升甚至溢出,使A瓶中的压力稳定,故答案为:分液漏斗;气密性检验;瓶A中的压力过大时,安全管中的液面上升甚至溢出,使A瓶中的压力稳定;
(2)NaOH是碱性溶液,标准NaOH溶液应装入碱式滴定管中,C装置冰盐水可以降温,使氨气全部被盐酸标准溶液吸收,故答案为:碱;降温,使氨气全部被盐酸标准溶液吸收;
(3)硝酸银见光容易分解,测定氯的过程中,使用棕色滴定管可以防止(或减少)硝酸银见光分解;当滴入最后一滴标准AgNO3溶液锥形瓶中出现(砖、浅)红色沉淀且半分钟内不消失,表示达到了滴定终点,c(CrO42-)=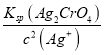 =
=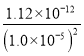 mol/L=1.12×10—2 mol/L,故答案为:防止(或减少)硝酸银见光分解;滴入最后一滴标准AgNO3溶液锥形瓶中出现(砖、浅)红色沉淀且半分钟内不消失;1.12×10—2;
mol/L=1.12×10—2 mol/L,故答案为:防止(或减少)硝酸银见光分解;滴入最后一滴标准AgNO3溶液锥形瓶中出现(砖、浅)红色沉淀且半分钟内不消失;1.12×10—2;
(4)与氨气反应的n(HCl)=0.02L×0.2molL-1-0.2molL-1 ×0.005L=0.003mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=0.003mol×![]() =0.3mol,故答案为:0.3;
=0.3mol,故答案为:0.3;
(5)经测定,样品X的化学式为Co(NH3)6Cl3,该反应中Co失电子、双氧水得电子,CoCl26H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O;双氧水易分解、气体的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,故答案为:2CoCl2+2NH4Cl+10NH3+H2O2
2[Co(NH3)6]Cl3+2H2O;双氧水易分解、气体的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,故答案为:2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O;温度过高,H2O2(NH4Cl)分解(或NH3挥发)从而减少反应物造成产率下降。
2[Co(NH3)6]Cl3+2H2O;温度过高,H2O2(NH4Cl)分解(或NH3挥发)从而减少反应物造成产率下降。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质或用途的说法不正确的是
A.常温下浓硫酸可贮存在铁罐中
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.燃着的镁条放入盛满二氧化碳的集气瓶中可继续燃烧
D.铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中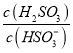 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。

下列说法正确的是
A. B区的OH通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e![]() H2↑
H2↑
C. 图中右管中的OH通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图

该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。

(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验(已知: NH4++OH-![]() NH3↑+ H2O):
NH3↑+ H2O):
(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A. K+一定存在,且100mL溶液中n(K+)≥0.02 mol
B. 100mL溶液中含0.01mol CO32-
C. Cl-一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
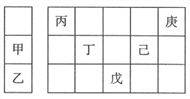
A. 丙与戊的原子序数相差25 B. 气态氢化物的稳定性:庚<己<戊
C. 丁的最高价氧化物可用于制造光导纤维 D. 常温下,甲和乙的单质能与水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为0.16 mol·L-1的CuSO4溶液。
①配制950 mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为________g。
②某学生实际配制CuSO4溶液的浓度为0.18 mol·L-1,原因可能是________。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式_______________________________。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。其中“于70 ℃真空干燥”的目的是____________; ______________________ (回答两点)。
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2===CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________。
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1 mol O2 参加反应有1 mol电子发生转移 D.Cu被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com