
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为0.16 mol·L-1的CuSO4溶液。
①配制950 mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为________g。
②某学生实际配制CuSO4溶液的浓度为0.18 mol·L-1,原因可能是________。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式_______________________________。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。其中“于70 ℃真空干燥”的目的是____________; ______________________ (回答两点)。
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2===CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________。
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1 mol O2 参加反应有1 mol电子发生转移 D.Cu被氧化
【答案】40.0AD2Cu2++SO![]() +2Cl-+H2O
+2Cl-+H2O![]() 2CuCl↓+SO
2CuCl↓+SO![]() +2H+加快乙醇和水的蒸发防止CuCl在空气中被氧化CD
+2H+加快乙醇和水的蒸发防止CuCl在空气中被氧化CD
【解析】
(1)①由于没有950mL的容量瓶,选择大于950mL相近规格的容量瓶,所以应选择1000mL规格容量瓶,根据化学式可知硫酸铜的物质的量等于硫酸铜晶体的物质的量,所以需要胆矾的质量为:1L×2mol/L×250g/mol=500g;②A.砝码生锈后增重,使称量的固体质量偏大,溶质的物质的量偏大,所配溶液的浓度偏高,选项A正确;B.容量瓶中原来存有少量蒸馏水,对溶质物质的量和溶液体积都不会产生影响,溶液的浓度不变,选项B错误;C.溶解后的烧杯未经多次洗涤,导致溶质的物质的量偏小,溶液的浓度偏低,选项C错误;D.胶头滴管加水定容时俯视刻度,导致溶液的体积偏小,溶液的浓度偏高,选项D正确;答案选AD;(2)Na2SO3、NaCl、硫酸铜溶液在加热条件下发生氧化还原反应生成氯化亚铜沉淀,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+;(3)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化;(4)A.O元素化合价降低,被还原,HO2为还原产物,选项A错误;B.HO2为超氧酸,应具有酸性,可与碱反应,选项B错误;C.HO2(超氧酸) 是一种弱酸,所以HO2 的电离方程式为HO2H++O2-,选项C正确;D.反应中Cu元素化合价由0价升高到+1价,Cu被氧化,选项D正确。答案选CD。
2CuCl↓+SO42-+2H+;(3)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化;(4)A.O元素化合价降低,被还原,HO2为还原产物,选项A错误;B.HO2为超氧酸,应具有酸性,可与碱反应,选项B错误;C.HO2(超氧酸) 是一种弱酸,所以HO2 的电离方程式为HO2H++O2-,选项C正确;D.反应中Cu元素化合价由0价升高到+1价,Cu被氧化,选项D正确。答案选CD。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在活性炭催化下,用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:
精确称取13.375 g X配成1000 mL溶液,取出10.00 mL溶液,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用20.00 mL 0.20 mol·L1的标准盐酸吸收。蒸氨结束后取下接收瓶,用0.20 mol·L1NaOH标准溶液滴定过剩的HCl,到终点时消耗5.00 mLNaOH溶液。

II、氯的测定:
准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,已知:Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.12×1012。
回答下列问题:
(1)仪器a的名称是_________测定氨前应该对装置进行__________,安全管的作用原理是_____________________________________________________。
(2)NaOH标准溶液应装入___式滴定管,C装置冰盐水的作用是_________。
(3)测定氯的过程中,使用棕色滴定管的原因是____________________;判断滴定终点的方法是___________________________________________________,若终点溶液中c(Ag+)=1.0×105 mol·L1,此时c(CrO42)为______ mol·L1。
(4)13.375 g样品X中氨的物质的量为_____ mol。
(5)经测定,样品X的化学式为Co(NH3)6Cl3,写出制备X的化学方程式:_________________;X的制备过程中,若温度过高X产率下降,原因是___________________。(写一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 次氯酸的结构式:H—Cl—O B. 乙醇的结构简式: C2H6O
C. 硫离子的结构示意图:![]() D. 丙烷分子的球棍模型:
D. 丙烷分子的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为石油裂解的主要产物,相对分子质量为28。B为气体,在标准状况下的密度为1.965g·L-1。D与F互为同分异构体,F是环状化合物。G的结构简式为:![]() 。在一定条件下,它们有如图所示的转化关系。
。在一定条件下,它们有如图所示的转化关系。
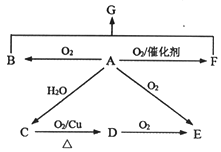
请回答:
(1)E中所含官能团名称________。
(2)B与F反应生成G的反应类型________。
(3)C→D的化学方程式________。
(4)下列说法正确的是________。(填编号)
A.A与O2在催化剂作用下反应也可以生成D B.不可以用金属钠检验C中是否含有少量水
C.可以用NaHCO3溶液鉴别C、D、E的水溶液 D.G可以在NaOH溶液或稀硫酸中发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有KI溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是 ( )
A.上层紫红色,下层接近无色
B.均匀、透明、紫红色
C.均匀、透明、无色
D.上层接近无色,下层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
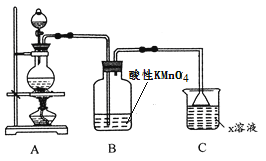
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为____________。C装置的作用_____________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
验证该气体的实验方案如下:
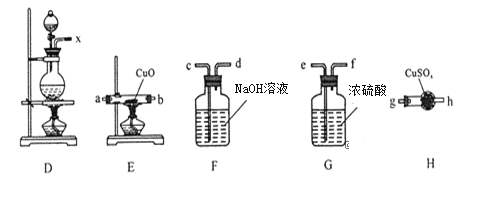
①装置连接顺序:X→ ___→___→___→___→a→b→_____;
②能证明上述假设成立的实验现象是_____________。
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处__________________________。
④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的某离子,可供选用的试剂: a、Cl2;b、Br2;c、稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填字母),反应的离子反应方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. NaCl===Na++Cl-、NH3·H2O![]() NH4++OH-均属于电离方程式
NH4++OH-均属于电离方程式
B. 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀说明该溶液中一定有SO42-
C. Ba2++SO42-===BaSO4↓、HCO3-+OH-===CO32-+H2O均可表示一类反应
D. Cl2+2NaOH===NaCl+NaClO+H2O、3S+6NaOH===2Na2S+Na2SO3+3H2O,Cl2和S在反应中既做氧化剂又做还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为______________(填序号)。
(2)25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示,反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是________。反应结束后所得两溶液中,c(CH3COO-)____c(SCN-)(填“>”、“<”或“=")。

(3)若保持温度不变,在醋酸溶液中加少量盐酸,下列量会变小的是___(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用有机物C3H8为原料制取乙酸乙酯。它们之间的转化关系如图:

已知:CH2=CH2+CH3COOH![]() CH3COOCH2CH3,下列说法正确的是( )
CH3COOCH2CH3,下列说法正确的是( )
A. 反应过程①在石油工业上称作分馏,属于化学变化
B. 用新制碱性氢氧化铜悬浊液可区分有机物B、C 和D
C. 通过直接蒸馏乙酸乙酯和有机物C 的混合物,可分离得到纯的乙酸乙酯
D. 相同条件下乙酸乙酯在氢氧化钠溶液中水解不如在稀硫酸中完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com