
【题目】工业上用有机物C3H8为原料制取乙酸乙酯。它们之间的转化关系如图:

已知:CH2=CH2+CH3COOH![]() CH3COOCH2CH3,下列说法正确的是( )
CH3COOCH2CH3,下列说法正确的是( )
A. 反应过程①在石油工业上称作分馏,属于化学变化
B. 用新制碱性氢氧化铜悬浊液可区分有机物B、C 和D
C. 通过直接蒸馏乙酸乙酯和有机物C 的混合物,可分离得到纯的乙酸乙酯
D. 相同条件下乙酸乙酯在氢氧化钠溶液中水解不如在稀硫酸中完全
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为0.16 mol·L-1的CuSO4溶液。
①配制950 mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为________g。
②某学生实际配制CuSO4溶液的浓度为0.18 mol·L-1,原因可能是________。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式_______________________________。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。其中“于70 ℃真空干燥”的目的是____________; ______________________ (回答两点)。
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2===CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________。
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1 mol O2 参加反应有1 mol电子发生转移 D.Cu被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制200 mL 1.84 mol·L-1的稀硫酸,提供的仪器有:A.100 mL量筒,B.20 mL量筒,C.200 mL容量瓶,D.500 mL容量瓶,E.50 mL烧杯,F.胶头滴管,G.玻璃棒。
(1)配制该溶液,应取用浓硫酸的体积为________。
(2)实验操作过程中,应选用仪器的先后顺序是________________(填字母)。
(3)配制过程中若出现以下情况,对所配稀硫酸的浓度有什么影响?(填“偏大”“偏小”或“无影响”)
①用量筒量取浓硫酸时,俯视量筒刻度线:________。
②用于引流的玻璃棒没有洗涤:________________。
③定容时,仰视观察容量瓶刻度线:________________。
④定容后摇匀,发现液面低于刻度线,又滴加水至液面与刻度线刚好相平:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据学过的化学知识填空:
(1)金刚石和石墨物理性质差异较大的原因是____________________;一氧化碳和二氧化碳性质不同的原因是_____________________。
(2)天然气的主要成分燃烧的化学方程式是_________________________。
(3)煤在空气中燃烧需要满足的条件是__________;吹灭蜡烛的原理是____________。
(4)生铁和钢都是铁的合金,由于________不同,二者性能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )

A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
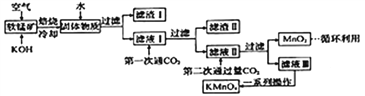
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
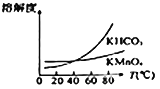
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com