
下列排列顺序不正确的是
A.熔点:Al>K>Na B.微粒的半径:Cl- >Na+>Mg2+>Al3+
C.热稳定性:HF>HCl>HBr>HI D.结合质子能力:AlO-2>CO32->F-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:选择题
下列实验操作与预期的实验目的或结论均正确的是
选项 | 实验操作 | 预期的实验目的或结论 |
A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质为钠盐 |
B | SO2通入某红色溶液中,溶液褪色 | 该溶液为品红溶液 |
C | 蔗糖溶液中加入少量稀硫酸加热,然后加银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
D | pH均为1的盐酸、醋酸溶液分别用蒸馏水稀释m倍、n倍后的pH相同 | m<n |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:简答题
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.在反应中消耗1mol Cl2,转移的电子数一定为2NA。
B.标准状况下,0.5mol氦气含有的电子数为NA
C.15g CH3+(碳正离子)中含有电子数为10NA
D.0.1L 2mol·L﹣1的(NH4)2S溶液中含有的S2﹣数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.B、D在周期表中的相对位置关系如图.下列说法正确的是

A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出
B.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为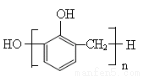
C.醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物
D.叶酸的结构为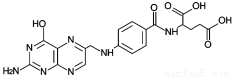 ,它可以发生酯化、水解、加成等反应
,它可以发生酯化、水解、加成等反应
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:实验题
(16分)(原创)硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。
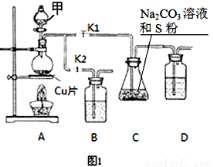
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:
。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、
。(用离子方程式表示)
②装置B、D的作用是 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为: →g,h→ , → , →d。
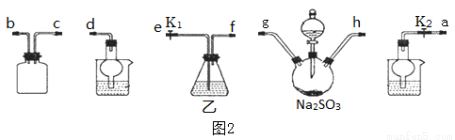
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程
式为: 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)能用键能大小解释的是
A.稀有气体一般很难发生化学反应
B.常温常压下,氟气的密度小于氯气
C.相同条件下,NH3在水中的溶解度大于PH3
D. SiC晶体的熔点比晶体硅的高
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
实验室用溴和苯反应制取溴苯,得到粗产品后要用如下方法加以提纯:①蒸馏 ②水洗③干燥剂干燥 ④用10%的氢氧化钠溶液洗,正确的操作顺序是
A.②④②③① B.①②③④ C.④②③①② D.②④①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com