
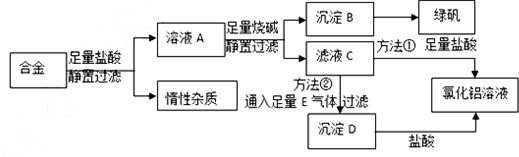
分析 铝、铁合金(含某种不溶于酸和碱的惰性杂质)的合金加入足量盐酸溶解,过滤,得到滤液A为氯化铝、氯化亚铁,加入足量氢氧化钠溶液过滤得到滤液C为偏铝酸钠溶液,和沉淀B为氢氧化亚铁,氢氧化亚铁和硫酸反应可得硫酸亚铁溶液,进而获得硫酸亚铁晶体,滤液C中加入足量的盐酸氯化铝溶液,滤液C中通入二氧化碳生成沉淀D为氢氧化铝,氢氧化铝中加入盐酸也生成氯化铝溶液,据此答题.
解答 解:铝、铁合金(含某种不溶于酸和碱的惰性杂质)的合金加入足量盐酸溶解,过滤,得到滤液A为氯化铝、氯化亚铁,加入足量氢氧化钠溶液过滤得到滤液C为偏铝酸钠溶液,和沉淀B为氢氧化亚铁,氢氧化亚铁和硫酸反应可得硫酸亚铁溶液,进而获得硫酸亚铁晶体,滤液C中加入足量的盐酸氯化铝溶液,滤液C中通入二氧化碳生成沉淀D为氢氧化铝,氢氧化铝中加入盐酸也生成氯化铝溶液,
(1)根据上面的分析可知,沉淀B为氢氧化亚铁,
故答案为:氢氧化亚铁;
(2)方法①偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而方法②向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,所以方法②更合理,方法②中偏铝酸钠和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,反应的方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:②;因为方法①中得到的AlCl3溶液中含有大量的氯化钠杂质,方法②得到的是纯净的AlCl3溶液;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)铝、铁合金在烧碱中铝和氢氧化钠反应,铁不反应,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
故答案为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑.
点评 本题考查物质的制备,为高考常见题型,题目涉及实验方案的分析、化学方程的书写、物质的分离和提纯等知识,难度中等,充分考查了学生分析、理解能力及灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H${\;}_{2}^{\;}$18O | |
| B. | 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Cu2+、SO42-、NO3- | B. | Cl-、Na+、SO42-、CH3COO- | ||
| C. | Cl-、Fe2+、MnO4-、NO3- | D. | AlO2-、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com