
| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
分析 根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答 解:20mL1mol/Al2(SO4)3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
c=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=$\frac{0.15mol}{0.03L}$=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答.


科目:高中化学 来源: 题型:实验题
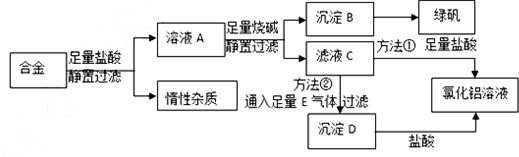
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | HOCH2CH2OH | C. | HOOC-COOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| B. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | CuSO4溶液:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| D. | NaClO溶液:ClO-+H2O═HClO+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
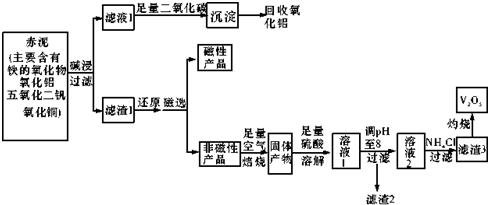
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

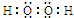 ;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).
;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 69 | B. | 68 | C. | 70 | D. | 71 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com