
【题目】人们研究金星大气成分,发现金星大气中有一种称之为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测肯定不正确的是( )
A. COS分子中含有极性键 B. COS属于离子化合物
C. COS的结构式为S=C=O D. COS分子中所有原子都满足8电子稳定结构
科目:高中化学 来源: 题型:
【题目】如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是
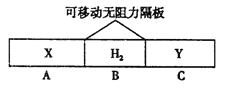
A. 摩尔质量: M(X)=M(Y) B. 分子数目:N(X)=N(Y)
C. 气体的体积:V(X)=V(Y) D. 物质的量: n(X)<n(H2)<n(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是: ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c (OH﹣)/ c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.

则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)= .(填准确数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料. 
(1)单质A的名称 .
(2)写出E与A的氢化物反应生成A的化学方程式 .
(3)写出一个由D生成B的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.Al2O3是两性氧化物,可用作耐高温材料
B.氯化铁溶液呈酸性,可用于蚀刻铜电路板
C.晶体硅熔点高、硬度大,可用于制作半导体材料
D.Fe粉具有还原性,可用作食品袋中的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 由CO2和O2组成的混合物中共有NA个分子,其中所含原子总数可能为![]()
B. 10 g质量分数为46%的乙醇水溶液中含有的氢原子总数为0.6NA
C. 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D. NA个Fe(OH)3与1L3mol·L-1HI溶液完全反应后,溶液中c(I-)为2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列方程式:
(1)纯碱的电离方程式:_____
(2)实验室制备乙酸甲酯的化学反应方程式:_____
(3)做Cl2的相关实验时常用烧碱溶液处理尾气,发生的离子反应方程式:_____
(4)碱性氢氧燃料电池常用KOH溶液做电解质溶液,其正极电极反应式:_____
(5)已知中和热为57.3KJ/mol,写出Ba(OH)2溶液与稀盐酸反应的热化学方程式:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率________(填“增大”、“减小”、或“不变”)。
(2)600 ℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10 min和20 min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,前10 min正反应速率逐渐____(填“增大”、“减小”或“不变”);前15 min内用SO3表示平均反应速率为________。

(3)图中反应进程,表示正反应速率与逆反应速率相等(即达到平衡状态)的时间段是_____________。
(4)根据如图判断,10 min时改变的条件可能是_______________________________(选填下面编号,下同);20 min时改变的反应条件可能是________。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com