
【题目】工业上用软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质),制备KMnO4的流程图如下:
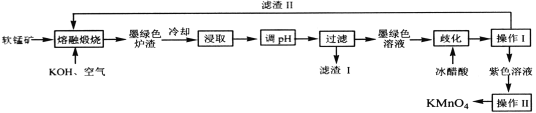
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性,能发生可逆的歧化反应。
下列说法正确的是
A.向“浸取”后的溶液中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为Al(OH)3
B.“歧化”时,加入冰醋酸是为了调节溶液pH,使3MnO![]() +2H2O
+2H2O![]() 2MnO
2MnO![]() +MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
+MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
C.“歧化”步骤中调节溶液pH时,可以用浓盐酸来代替冰醋酸
D.“操作II”时,当有大量晶体析出时,利用余热蒸干,即得紫黑色KMnO4晶体
【答案】B
【解析】
软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质)加入KOH与空气,形成K2MnO4固体、硅酸钠和偏铝酸钾,冷却后调节pH值使无关元素沉淀,加入冰醋酸后锰酸钾发生可逆歧化反应。操作Ⅰ为过滤,滤渣Ⅱ能回归熔融第一步,说明滤渣Ⅱ为二氧化锰,紫色溶液经过蒸发浓缩结晶形成高锰酸钾晶体。
A. 向“浸取”后的溶液中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为Al(OH)3和硅酸,A错误;
B. “歧化”时,加入冰醋酸是为了调节溶液pH,使3MnO![]() +2H2O
+2H2O![]() 2MnO
2MnO![]() +MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率,B正确;
+MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率,B正确;
C. “歧化”步骤中若用浓盐酸调节溶液pH时,浓盐酸会与二氧化锰反应,生成有毒氯气,且使溶液中离子不仅有高锰酸根还有锰离子,C错误;
D.高锰酸钾受热易分解,不能用蒸发结晶的方式提纯,“操作II”应为蒸发浓缩冷却结晶,D错误。
答案为B。


科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
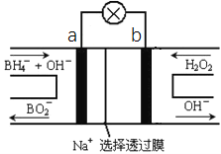
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
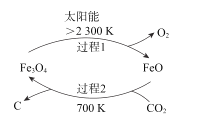
【题目】二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为__;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。
CH3OH+H2O。
已知298K和101kPa条件下:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=__;
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0
②2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是__。
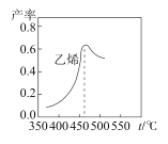
A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭体系中进行的可逆反应:A(g)+2B(g)![]() C(g)+D(g),下列不能说明反应达到平衡状态的是
C(g)+D(g),下列不能说明反应达到平衡状态的是
A.![]() 正(B)=2
正(B)=2![]() 逆(C)B.n(A):n(D)=1:1
逆(C)B.n(A):n(D)=1:1
C.容器内压强不再改变D.容器内混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,北京航空航天大学教授团队与中科院高能物理研究所合作,合成了Y、Sc(Y1/NC,Sc1/NC)单原子催化剂,用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法错误的是
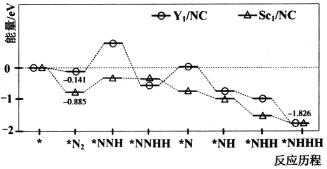
A.相同条件下,两种催化反应的焓变相同
B.实际生产中将催化剂的尺寸处理成纳米级颗粒可提高氨气的平衡转化率
C.使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H→*NNH
D.升高温度一定可以提高氨气单位时间内的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O,部分夹持仪器已略去)
CaCl2+2NH3+2H2O,部分夹持仪器已略去)
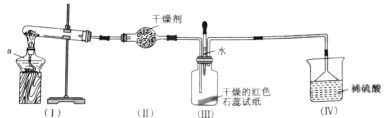
(实验探究)(1)装置(I)中仪器a的名称是_____。
(2)装置(Ⅱ)中可用_________(填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___(填“白色”或“蓝色”)原因是氨水呈____(填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______(填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________。
(5)装置(IV)中稀硫酸的作用是___________。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____mol。
(实验拓展)(7)已知:2NH3+3CuO![]() 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
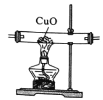
(知识应用)(8)氨气是一种重要的化工原料。写出它的一种用途:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
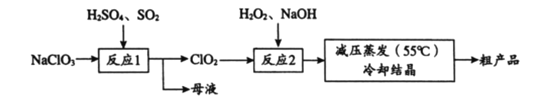
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com