
����Ŀ�����⻯��NaBH4(BԪ�صĻ��ϼ�Ϊ+3��)ȼ�ϵ��(DBFC), ���ھ���Ч�ʸߡ������������Ⱦ��ȼ�����ڴ����������ŵ㣬����Ϊ��һ�ֺ��з�չDZ����ȼ�ϵ�ء��乤��ԭ������ͼ��ʾ������˵����ȷ����
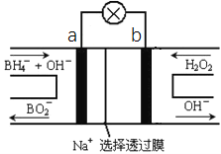
A. ��صĸ�����ӦΪBH4��+2H2O��8e��=BO2��+8H+
B. �ŵ�ʱ��ÿת��2mol���ӣ���������Ҫ����9.5gNaBH4
C. ��طŵ�ʱNa+��b��������a����
D. �缫a����MnO2��MnO2�����缫�������д�����
���𰸡�B
��������
�����⻯����NaBH4��BԪ�صĻ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϵ�ȼ�ϵ�أ��������Һ�ʼ��ԣ��ɹ���ԭ��װ��ͼ��֪����������������Ӧ���缫��ӦʽΪBH4-+8OH--8e-=BO2-+6H2O������H2O2������ԭ��Ӧ���õ����ӱ���ԭ����OH-���缫��ӦʽΪH2O2+2e-=2OH-�����ԭ��صĹ���ԭ���ͽ�����
A����������������Ӧ����BO2-���缫��ӦʽΪBH4-+8OH--8e-=BO2-+6H2O����A����
B����������������Ӧ����BO2-���缫��ӦʽΪBH4-+8OH--8e-=BO2-+6H2O��
ÿת��2mol���ӣ���������Ҫ����0.25mol��9.5gNaBH4����B��ȷ��
C��ԭ��ع���ʱ���������������ƶ������������ƶ�����Na+��a��������b��������C����
D���缫b����MnO2��Ϊ������H2O2������ԭ��Ӧ���õ����ӱ���ԭ����OH-��MnO2�����缫�������д����ã���D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�DME������Ϊ��21���͵����ȼ�ϡ����ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
�� CO(g)+2H2(g)![]() CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1
�� 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
�� CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
�ش��������⣺
��1����Ӧ3H2(g)��3CO(g)![]() CH3OCH3(g)��CO2(g) ��H��____kJ��mol-1��
CH3OCH3(g)��CO2(g) ��H��____kJ��mol-1��
���д�ʩ�У������CH3OCH3���ʵ���____��
A��ʹ�ú��ʵĴ��� B�������¶� C������ѹǿ
��2�����ϳ�����n(H2)/n(CO)=2ͨ��1 L�ķ�Ӧ���У�һ�������·�����Ӧ��4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ����____��
CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ����____��
A����H < 0
B��P1<P2<P3
C������P3��316��ʱ����ʼn(H2)/n(CO)=3����ﵽƽ��ʱ��COת����С��50��
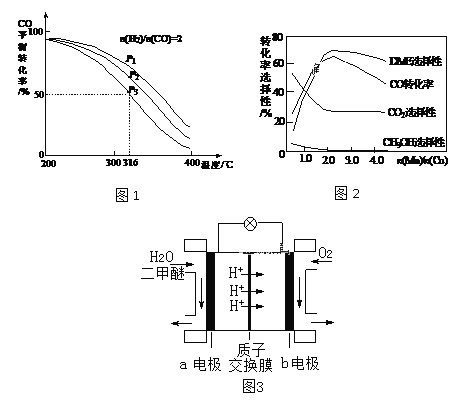
��3������һ�����͵Ĵ�������Ҫ�ɷ���Cu-Mn�ĺϽ𣩣�����CO��H2�Ʊ������ѡ��۲�ͼ2�ش����⡣������n(Mn)/n(Cu)ԼΪ____ʱ�������ڶ����ѵĺϳɡ�
��4��ͼ3Ϊ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��b�缫�ĵ缫��ӦʽΪ____��
��5���״�Һ����ˮ���ƶ����ѵ�ԭ���ǣ�
CH3OH +H2SO4 �� CH3HSO4+H2O��
CH3 HSO4+CH3OH �� CH3OCH3+H2SO4��
��ϳ����Ʊ������ѱȽϣ��ù��յ��ŵ��Ƿ�Ӧ�¶ȵͣ�ת���ʸߣ���ȱ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����֧�Թ��ڱ���ˮʪ��������ۡ�̼�ۣ����ܲ��뵽��īˮ�С���������������ǣ� ��
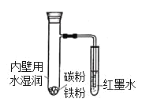
A.��֧�Թܵײ�����
B.�����缫��Ӧʽ��Fe-2e-=Fe2+
C.��Ӧ���������յ�����Һ���½�
D.�����缫��Ӧʽ��2H2O+O2+4e-=4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50mL0.50mol/L���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50mL0.55mol/L NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У���Ͼ��ȣ���û��Һ����¶ȡ�
�ش��������⣺
(1)д���÷�Ӧ���Ȼ�ѧ����ʽ����֪����lmolҺ̬ˮ�ķ�Ӧ��Ϊ��57.3kJ/mol��______________________��
(2)�ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ�� 1L1mol/L����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�ΪH1��H2��H3����H1��H2��H3�Ĵ�С��ϵΪ________________________��
(3)�������������������Һ���ܶȶ���1g/cm3����֪�кͷ�Ӧ��������Һ�ı�����c=4.18J/(g����)��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼���������
ʵ����� | ��ʼ�¶� | ��ֹ�¶� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к���H_____(�������һλС��)��
(4)�����60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������__________ (���ȡ�����ȡ�)�������к���__________(���ȡ�����ȡ�)��
(5)���ü������ȼƲ�������������������������Һ�кͷ�Ӧ�ķ�Ӧ�ȣ����д�ʩ�������ʵ�龫�ȵ�����_______��
A��������Һ��(��ȷ��0.01 mL)������Ͳ(��ȷ��0.1 mL)��ȡ��ӦҺ
B�����ٽ�����Һ��ϣ����ٽ��貢��¼����¶�
C�����ڡ���Ͳ֮�����������ʣ���ֹ������ʧ
D��������Ϊ500����¶ȼƴ�������Ϊ100����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. 46g�Ҵ��д��ڵĹ��ۼ�����Ϊ7NA
B. 1mol�״���ȫȼ��ʱ��ת�Ƶĵ�����Ϊ6NA
C. ��״���£�22.4L�����22.4L�ȷ������е�������ΪNA
D. 1 L 0.1mol/L������Һ�к��е���������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���йػ�ѧ��Ӧ�������仯��˵����ȷ����( )

A. ͼa��ʾ�������ȷ�Ӧ�������仯
B. ͼaһ����Ҫ���Ȳ��ܷ�����ͼb������Ҳ�ܷ���
C. ͼb�з�Ӧ����������ȶ�
D. ͼb���Ա�ʾ�Ȼ�粒����������������巴Ӧ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯���������ǵ��ճ����������Ź㷺����;���ش��������⣺
(1)ͭ��ͭ�ε���ɫ��ӦΪ��ɫ���ù�����________(�������չ������������������)��
(2)��̬Cuԭ���У��������ռ�ݵ�����ܲ������________����۵��Ӳ�ĵ����Ų�ʽΪ___________��Cu��Ag������IB�壬�۵㣺Cu________Ag (����>������<��)��
(3)[Cu(NH3)4]SO4 �������ӵ����幹����_______������ԭ�ӵĹ���ӻ�����Ϊ_____��[Cu(NH3)4]SO4 ��Cu2����NH3֮���γɵĻ�ѧ����Ϊ_______________��
(4)��Cu���������������Ҵ�������ȩ����ȩ�ٱ����������ᣬ�����ʵ�������ȩ����������������Ŀ��Ϊ_____________��
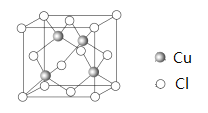
(5)�ȡ�ͭ����Ԫ�صĵ縺������� CuCl����________(��������������������)�����
Ԫ�� | Cl | Cu |
�縺�� | 3.2 | 1.9 |
(6)Cu ��Cl �γ�ij�ֻ�����ľ�����ͼ��ʾ���þ�����ܶ�Ϊ�� g��cm��3�������߳�Ϊa cm�����ӵ�����Ϊ______________(�ú�����a�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���е���������NO��NO2������������Һ���յ���Ҫ��ӦΪ��2NO2+2NaOH=NaNO2+NaNO3+H2O��NO2+NO+2NaOH=2NaNO2+H2O������aL����״����NO��NO2������屻��������������Һ���գ�û��������࣬����˵������ȷ���� �� ��
A.ʵ�ʲμӷ�Ӧ���������Ƶ����ʵ�����a/22.4 mol
B.�������������NO2���һ�����ڣ����ڣ�NO���
C.��Һ��NaNO3���ʵ���һ��С�ڣ����ڣ�NaNO2���ʵ���
D.�����ɵ�NaNO2��NaNO3�����ʵ���֮��Ϊ3��1������������NO��NO2�������Ϊ3��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com