
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
(2)基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag (填“>”或“<”)。
(3)[Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
(5)氯、铜两种元素的电负性如表: CuCl属于________(填“共价”或“离子”)化合物。
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
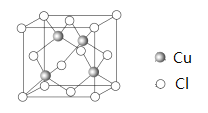
(6)Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为______________(用含ρ、a的代数式表示)。
【答案】发射光谱 K 3d104s1 > 正四面体 sp3 配位键 6:7 共价 ![]() mol-1
mol-1
【解析】
(1)基态原子的电子吸收能量,跃迁到较高能级,电子又从高能级跃迁到低能级,以光的形式释放能量;
(2)基态Cu原子的核外电子排布式为:1s22s22p63s23p63d104s1。其3d、4s能级上电子为其价电子。金属键越强,其熔沸点越高;
(3)SO42-中硫原子的价层电子对数为4,孤电子对数为0,根据价层电子互斥理论判断。Cu2+含有空轨道,NH3中氮原子有孤电子对;
(4)单键为σ键,双键含有1个σ键、1个![]() 键;
键;
(5)二者电负性的差为1.3小于1.7;
(6)推导出公式NA=![]() 计算。
计算。
(1)基态原子的电子吸收能量,跃迁到较高能级,电子又从高能级跃迁到低能级,以光的形式释放能量,为发射光谱;
(2)基态Cu原子的核外电子排布式为:1s22s22p63s23p63d104s1,核外电子占据能量最低的能层为K层,其3d、4s能级上电子为其价电子,其价电子排布式为3d104s1;Cu的离子半径比Ag的小,Cu的金属键更强,金属键越强,其熔沸点越高,所以熔沸点Cu>Ag;
(3)SO42-中硫原子的价层电子对数为4,孤电子对数为0,所以为正四面体结构且硫原子采用sp3杂化。Cu2+含有空轨道,NH3中氮原子有孤电子对,二者形成的化学键为配位键;
(4)乙醛分子中有4个C-H键、1个C-C键、1个C=O双键。乙酸分子中有4个C-H键、1个C-C键、1个C=O键、1个C-O键、1个O-H键。单键为σ键,双键含有1个σ键、1个![]() 键,所以等物质的量的乙醛与乙酸中σ键的数目比为6:7;
键,所以等物质的量的乙醛与乙酸中σ键的数目比为6:7;
(5)二者电负性的差为1.3,小于1.7,不是离子化合物,所以CuCl属于共价化合物;
(6)该晶胞中含氯原子个数=8![]() =4、铜原子4个,晶胞体积=a3cm3,晶胞密度
=4、铜原子4个,晶胞体积=a3cm3,晶胞密度![]() =
=![]() ,则NA=
,则NA=![]() mol-1=
mol-1= ![]() mol-1。
mol-1。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列说法错误的是( )
A. c(H+)为1.0×10-4mol·L-1的醋酸溶液的pH=4
B. 0.1 mol·L-1某酸溶液的pH=1
C. 0.01 mol·L-1氨水的pH<12
D. pH=3的醋酸溶液的浓度大于1.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
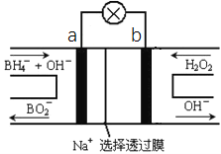
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_____。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是____,说明该反应属于___(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_____;
②若观察到烧杯里产生气泡,则说明M溶于水____(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。W和Y同主族,X和Z同主族,W与X形成的二元化合物有两种,常温下均是液体;Y与Z的电子层数相同;向过量的YWZ溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是( )
A.YWZ是共价化合物
B.最简单气态氢化物的沸点:X>Z
C.原子半径由小到大的顺序为:r(W)<r(X)<r(Y)<r(Z)
D.简单离子的氧化性:W<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性,试解释原因______。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
B c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用下列实验装置探究氯气与过量氨气反应的实验,有关说法不正确的是
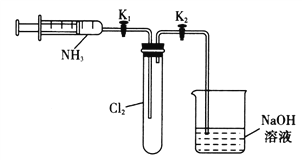
A. 打开K1,关闭K2,将注射器的活塞往外拉一小段,然后松开,活塞复原,说明装置气密性良好
B. 打开K1,推动注射器的活塞使过量的氨气与氯气混合时,产生大量的白色烟雾
C. 充分反应后,关闭K1,打开K2,可观察到烧杯中的溶液会倒吸至试管内
D. 实验室制备氨气和氯气可以用同一套发生装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com