
����Ŀ��ijʵ����ȤС����������ʵ��װ��̽�����������������Ӧ��ʵ�飬�й�˵������ȷ����
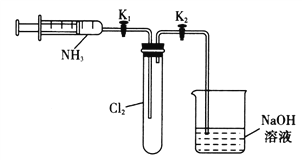
A. ��K1���ر�K2����ע�����Ļ���������һС�Σ�Ȼ���ɿ���������ԭ��˵��װ������������
B. ��K1���ƶ�ע�����Ļ���ʹ�����İ������������ʱ�����������İ�ɫ����
C. ��ַ�Ӧ�ر�K1����K2���ɹ۲쵽�ձ��е���Һ�ᵹ�����Թ���
D. ʵ�����Ʊ�����������������ͬһ����װ��
���𰸡�B
��������A. ��K1���ر�K2����ע�����Ļ���������һС�Σ�Ȼ���ɿ���������ԭ��˵��װ�ò�©�������������ã���A��ȷ��B. ��K1���ƶ�ע�����Ļ���ʹ�����İ������������ʱ�������İ�����������Ӧ���ɵ������Ȼ�泥�ֻ���������İ��̣�û��������B����C. ��ַ�Ӧ��װ���ڵ�����ѹǿ��С�����ɼ�������ˮ�����壬�ر�K1����K2���ɹ۲쵽�ձ��е���Һ�ᵹ�����Թ��ڣ���C��ȷ��D. ʵ�����Ʊ�����������������ʹ�ù�����Һ���Ʊ����Ʊ���������ѡ��Ũ��ˮ�������ƣ��Ʊ���������ѡ�ø�����غ�Ũ���ᣬ������ͬһ����װ�ã���D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
��1��ʳƷ����ù�䣬����Ͳ���������������
��2������طų����ݺ��������������������̺ܿ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ[Mg(ClO3)2]����������������ݼ��ȣ���ҵ���ģ����ǰ��ʵ�����Ȱ��������̽���ģ���Ʊ�����Mg(ClO3)2��6H2O��
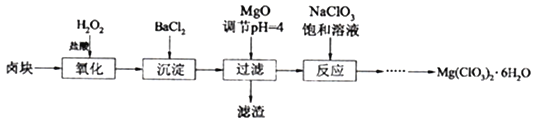
��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O,����MgSO4��FeCl2�����ʡ������ֻ�������ܽ��(S)���¶�(T)�仯��������ͼ��
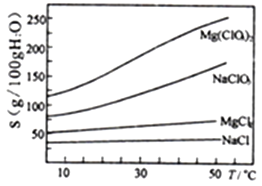
��1��±���м�H2O2��Ŀ����________________��д���÷�Ӧ�����ӷ���ʽ__________________��
��2������BaCl2��Ŀ���dz�ȥSO42-,��μ���SO42-�ѳ�����ȫ��_________________��
��3�������£���MgO����pH=4����Һ��c(Fe3+)=___________(��֪Ksp[Fe(OH)3=4��10-38]������������������Ҫ�ɷ���______________��
��4������NaClO3������Һ����NaCl����������д���÷�Ӧ�Ļ�ѧ����ʽ��___________�������ø÷�Ӧ�������ͼ����ȡMg(ClO3)2��6H2O��ʵ�鲽������Ϊ��
��ȡ��������NaClO3������Һ��ַ�Ӧ���������ᾧ����___________������ȴ�ᾧ����������ϴ�ӣ����Mg(ClO3)2��6H2O���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L�ܱ������У���1 mol A��1 mol B��Ϸ������·�Ӧ��3A(g)+B(g) ![]() xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
A. x��ֵΪ2 B. A��ת����Ϊ60%
C. B��ƽ��Ũ��Ϊ0.8 mol/L D. D���������Ϊ25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ʵ����Ԥ����Ҫʹ��480mLamol/L�Ĵ�����Һ��������ijͬѧ��ʵ�������Ƹ���Һ������ͼ���ش��������⣺

��1������ͼ�е����ƹ������˵ڢݲ�����ָ��ȱ�ٵIJ���������_____________________________
��2����ѡ����ƿ����ʵ�vֵΪ____________������ͼʾ��������ݣ������a=__________.����ƿ��ʹ��֮ǰ������е�һ�������________________________��
��3��������������ͼ�����ֳ��IJ����������������Դ������в�����ȱ�ٵĵڢݲ�������д����
��__________________________��________________________��__________________________��
��4��ָ������ʵ������Խ���Լ�����������ҺŨ�ȵ�Ӱ�죬��д��ƫ������ƫС����������Ӱ������
���ܽ��û��ϴ�Ӳ������Լ��ձ���_________________
�ڶ���ʱ���ӿ̶��ߣ�_________________
��δ����ȴ���Ƚ���Һע������ƿ��______________
������ƿϴ�Ӻ�δ�����ﴦ��_______________
��ҡ�Ⱥ���Һ����ڿ̶�������ˮ����______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش������й����⡣
(1)��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol��ұ������Ӧ��ƽ�ⳣ������ʽK=____________���¶����ߺ�K ֵ________������������䡱��С������
2Fe(s)+3CO2(g) H=-28.5kJ/mol��ұ������Ӧ��ƽ�ⳣ������ʽK=____________���¶����ߺ�K ֵ________������������䡱��С������
(2)��֪����Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
��C��ʯī��+ CO2(g) = 2CO(g�� H3= akJ/mol ,
��a=__________kJ/mol��
(3)��T��ʱ����ӦFe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64����2L�����ܱ������У����±���ʾ�������ʣ�����һ��ʱ���ﵽƽ�⡣
2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64����2L�����ܱ������У����±���ʾ�������ʣ�����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
ʼ̬mol | 1.0 | 1.0 | 1.0 | 1.0 |
��ƽ��ʱCO ��ת����Ϊ_______��
�����������־��Ӧ�ﵽƽ��״̬����________������ĸ����
a�������������ܶȱ��ֲ���
b������������ѹǿ���ֲ���
c��CO���������ʺ�CO2�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣�����m gij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪM g/mol���������ӵ�������NA��ʾ����
��1������������ʵ���Ϊ________mol��
��2������������ԭ������Ϊ____________����
��3���������ڱ�״���µ����Ϊ____________L��
��4������������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ_____________��
��5������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ____________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������������ȷ���ǣ� ��
A. �ױ���������ȫ�ӳɺ�����һ�ȴ������������5��
B. ����Һ���Ϻ�������ۿɷ����ӳɷ�Ӧ
C. 1 mol ƻ����(HOOCCHOHCH2COOH)����3 mol NaHCO3������Ӧ
D. ������-12�ĽṹʽΪ![]() ���÷�����ƽ���ͷ���
���÷�����ƽ���ͷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2Fe(SO4)2��6H2O]�������������ױ������������Ƿ�����ѧ����Ҫ���Լ��������ڴ������������������������ 500 ��ʱ��������������ȫ�ֽ⣬������������ԭ��Ӧ��������������FeO��Fe2O3��������������NH3��SO3��H2O��N2��SO2��
��1��Ϊ����ֽ����ijɷ֣��������ʵ��װ�ý���ʵ�飬����A�е�������������ֽ���ȫ��

��A�й����ּ��Ƚϳ�ʱ���ͨ�뵪����Ŀ����__________________________��
��Ϊ��֤A�в������Ƿ���FeO����Ҫѡ�õ��Լ���____________������ĸ����
A��KSCN��Һ B��ϡ���� C��Ũ���� D��KMnO4��Һ
��װ��B��BaCl2��Һ��������Ϊ�˼���ֽ�������Ƿ���________�������ɣ������и����壬�۲쵽������Ϊ_______________________________________��
����A�зֽ������N2�����������ֻ��Fe2O3��Fe2O3�����ʵ���Ϊb mol��C�г������ʵ���Ϊa mol����b________________a��������������С������������������
��ʵ���У��۲쵽C���а�ɫ�������ɣ���C�з����ķ�Ӧ�����ӷ���ʽΪ______________________
��2��Ϊ�ⶨij������Ʒ��(NH4)2Fe(SO4)2��6H2O�ĺ�����ijʵ��С����������ʵ�飺
����һ��ȷ����20.00 g��������茶��壬���Ƴ�100 mL��Һ��
�������ȡ������Һ25.00 mL����ƿ�У���ϡH2SO4�ữ��ʵ��ⶨ����16.00mL 0.1000 mol/L KMnO4��Һǡ����ȫ��Ӧ����֪(NH4)2Fe(SO4)2��6H2O��Ħ��������392g/mol�����Ʒ��(NH4)2Fe(SO4)2��6H2O����������Ϊ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com