
����Ŀ������þ[Mg(ClO3)2]����������������ݼ��ȣ���ҵ���ģ����ǰ��ʵ�����Ȱ��������̽���ģ���Ʊ�����Mg(ClO3)2��6H2O��
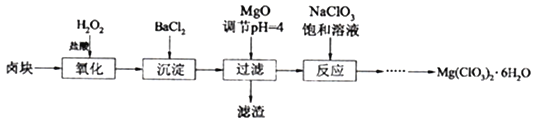
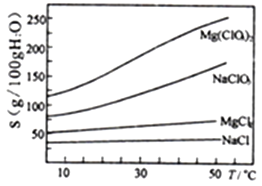
��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O,����MgSO4��FeCl2�����ʡ������ֻ�������ܽ��(S)���¶�(T)�仯��������ͼ��
��1��±���м�H2O2��Ŀ����________________��д���÷�Ӧ�����ӷ���ʽ__________________��
��2������BaCl2��Ŀ���dz�ȥSO42-,��μ���SO42-�ѳ�����ȫ��_________________��
��3�������£���MgO����pH=4����Һ��c(Fe3+)=___________(��֪Ksp[Fe(OH)3=4��10-38]������������������Ҫ�ɷ���______________��
��4������NaClO3������Һ����NaCl����������д���÷�Ӧ�Ļ�ѧ����ʽ��___________�������ø÷�Ӧ�������ͼ����ȡMg(ClO3)2��6H2O��ʵ�鲽������Ϊ��
��ȡ��������NaClO3������Һ��ַ�Ӧ���������ᾧ����___________������ȴ�ᾧ����������ϴ�ӣ����Mg(ClO3)2��6H2O���塣
���𰸡� ��Fe2+����ΪFe3+ 2Fe2++H2O2+2H+=2Fe3++2H2O ���ã�ȡ�ϲ���Һ����BaCl2�����ް�ɫ��������SO42-������ȫ 4��10-8 BaSO4��Fe(OH)3 MgCl2+2NaClO3=Mg(ClO3)2+2NaCl�� ���ȹ���
����������1��±���м�H2O2��Ŀ���ǽ�Fe2+����ΪFe3+����Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O����2����������������Ƿ�����ķ��������ã�ȡ�ϲ���Һ����BaCl2�����ް�ɫ��������SO42-������ȫ����3�������£���MgO����pH=4��c(OH-)=10-10mol/L��Ksp[Fe(OH)3= c(Fe3+) c3(OH-)= c(Fe3+)![]() (10-10mol/L)3=4��10-38����c(Fe3+)=4��10-8 mol/L����������þ��������Һ��pHΪ4����ʱ�������γ��˳��������������������Ѿ������������ֻ�Ӧ���������ᱵ�����������������������Ҫ�ɷ���BaSO4��Fe(OH)3����4������NaClO3������Һ����NaCl��������������������Mg(ClO3)2����Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaClO3=Mg(ClO3)2+2NaCl�����������ʵ��ܽ�ȴ�С����Һ��þ���ķ����������ᾧ�����ȹ��ˣ���ȴ�ᾧ��
(10-10mol/L)3=4��10-38����c(Fe3+)=4��10-8 mol/L����������þ��������Һ��pHΪ4����ʱ�������γ��˳��������������������Ѿ������������ֻ�Ӧ���������ᱵ�����������������������Ҫ�ɷ���BaSO4��Fe(OH)3����4������NaClO3������Һ����NaCl��������������������Mg(ClO3)2����Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaClO3=Mg(ClO3)2+2NaCl�����������ʵ��ܽ�ȴ�С����Һ��þ���ķ����������ᾧ�����ȹ��ˣ���ȴ�ᾧ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ���á�84����Һ��ͨ��ϡ��100��(���֮��)
��ʹ�á���ش��������⣺

��1���á�84����Һ�������ʵ���Ũ��ԼΪ_____mol��L��1��
��2��ȡ����������ĸ�����Һʱ�������������л�����ȡ����Ķ��ٶ��仯����________(����ĸ)��
A����Һ��NaClO�����ʵ��� B����Һ��Ũ��
C����Һ��NaClO��Ħ������ D����Һ���ܶ�
��3����ͬѧ���ĸá�84����Һ�����䷽������NaClO��������480 mL��NaClO��������Ϊ25%������Һ���ش��������⡣
����ͼ��ʾ�������У���Щ�Dz���Ҫ������������Һ����Ҫ_____________��������

����Ҫ����NaClO���������Ϊ_______ g
��4����84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ա��98%(�ܶ�Ϊ1.84 g��cm��3)��Ũ��������200 mL 2.3 mol��L��1��ϡ����������ǿ��84����Һ��������������
�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ________ mol��L��1��
������Ũ��������Ϊ________ mL��
���������Ƶ�ϡ����Ũ��ƫС�������п��ܵ�ԭ���������ȷ����_______��
A������ǰ������ƿ������������ˮ B����ȡŨ����ʱ������Һ��İ�Һ��
C��δ��ȴ������ת��������ƿ���� D������ʱ��������Һ�İ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ�������� ______ �����������е�����![]() ���ţ� ______
���ţ� ______ ![]() ��λ�� ______ �� ______ ��
��� ______ �� ______ ��
A. ��λ���ʵ�����M��![]() ��
��![]()
B. ���ʵ�����m��![]() ��
��![]()
C. ��λ���ʵ�����m��g��![]()
D. ���ʵ�����M��![]() ��kg
��kg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹���ѧ�ҹ��������ƺϳɰ������ش������1918��ŵ������ѧ�����������õ绯ѧ�ķ����ϳɰ���װ����ͼ��ʾ��ͼ���մ��ڸ���ʱ���Դ���H+������������������� ��
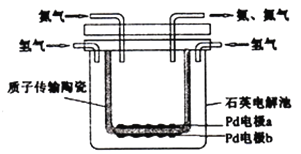
A. Pd�缫bΪ���� B. �����ķ�ӦʽΪ��N2+6H++6e-=2NH3
C. H+������������Ǩ�� D. �մɿ��Ը���N2��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ���ܴ���������ǣ� ����
A. ��ǿ����Һ�У�Na+��K+��AlO2����CO32��
B. ��pH=0����Һ�У�K+��Fe2+��Cl����NO3��
C. �ں�����Fe3+����Һ�У�NH4+��Na+��Cl����SCN��
D. ��c��H+��=10��13mol/L����Һ�У�NH4+��Al3+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȥ�����л��е���ϩ���õ������ļ��飬�������ͨ���� ��
A.��ˮ���ռ���Һ��ŨH2SO4
B.����KMnO4��Һ��ŨH2SO4
C.����ʯ��ˮ��ŨH2SO4
D.ŨH2SO4 �� ����KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ����ȤС����������ʵ��װ��̽�����������������Ӧ��ʵ�飬�й�˵������ȷ����
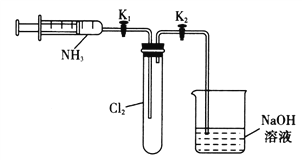
A. ��K1���ر�K2����ע�����Ļ���������һС�Σ�Ȼ���ɿ���������ԭ��˵��װ������������
B. ��K1���ƶ�ע�����Ļ���ʹ�����İ������������ʱ�����������İ�ɫ����
C. ��ַ�Ӧ�ر�K1����K2���ɹ۲쵽�ձ��е���Һ�ᵹ�����Թ���
D. ʵ�����Ʊ�����������������ͬһ����װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���пƴ������˹��ϳɽ��ʯ���·���,��ѧԭ��Ϊ��Na+CO2![]() C(���ʯ)+C(ʯī)+Na2CO3(δ��ƽ),���ֺϳɾ�����Զ�����塣����˵������ȷ����
C(���ʯ)+C(ʯī)+Na2CO3(δ��ƽ),���ֺϳɾ�����Զ�����塣����˵������ȷ����
A. �÷�Ӧ�У�������ԭ����������̼��������
B. ÿ����1mol Na2CO3ʱ,��ת��4mol����
C. �÷�Ӧ��Na2CO3����������
D. ��ԭ��Na����C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com