
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性,试解释原因______。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
B c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示,具支试管内壁用水湿润后,放入铁粉、碳粉,导管插入到红墨水中。下列描述错误的是( )
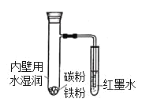
A.具支试管底部发热
B.负极电极反应式:Fe-2e-=Fe2+
C.反应结束后,最终导管内液面下降
D.正极电极反应式:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
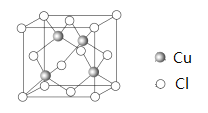
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
(2)基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag (填“>”或“<”)。
(3)[Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
(5)氯、铜两种元素的电负性如表: CuCl属于________(填“共价”或“离子”)化合物。
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
(6)Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为______________(用含ρ、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,在2L恒容密闭容器中投入0.20molNO和0.12mol O2发生下列反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化情况如下表:
2NO2(g),n(NO)随时间的变化情况如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.04 | 0.04 |
(1)800℃时,该反应平衡时的NO的物质的量浓度为______;升高温度,NO的平衡浓度为0.03molL-1,则该反应为_______反应(填“放热”或“吸热”)。
(2)用O2表示0~2s内该反应的平均反应速率v(O2)=______。
(3)能说明该反应一定达到平衡状态的是______。
a v(NO2)=2v(O2) b 容器内压强保持不变
c 容器内气体颜色保持不变 d 容器内气体密度保持不变
(4) 平衡后,下列措施能使该反应向正反应方向移动,且正反应速率增大的是____。
a 适当升高温度 b 适当降低温度
c 增大O2的浓度 d 选择高效催化剂
(5)800℃时,上述反应的平衡常数K=______,若容器中含1.00 molL-1 NO、2.00 molL-1O2和2.00 molL-1 NO2,则此时v正_______v逆 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点高于膦(PH3)的原因是___;PH3分子中P原子的杂化轨道类型为___。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___。
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是[SiO4]四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链结构的多硅酸根,该多硅酸根的化学式为___(用n代表聚合度)。

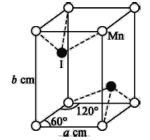
(5)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,其晶体密度的计算表达式为___g·cm-3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中氮的氧化物NO、NO2被氢氧化钠溶液吸收的主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O,现有aL(标准状况)NO和NO2混合气体被足量氢氧化钠溶液吸收,没有气体残余,下列说法不正确的是 ( )
A.实际参加反应的氢氧化钠的物质的量是a/22.4 mol
B.混合气体气体中NO2体积一定大于(等于)NO体积
C.溶液中NaNO3物质的量一定小于(等于)NaNO2物质的量
D.若生成的NaNO2与NaNO3的物质的量之比为3:1,则混合气体中NO与NO2的体积比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3-Fe(HSO3)2+(红棕色)
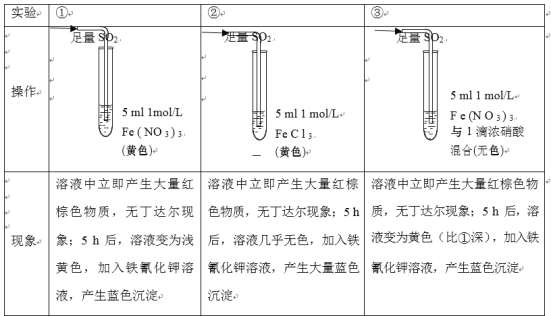
结合上述实验,下列说法不正确的是
A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率
B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响
C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性
D.5h后③比①黄色更深不能证明是NO3-浓度的增大减慢了SO2与Fe3+反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com