
【题目】下列有关有机化学的说法中正确的是( )
A.除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液
B.治疗疟疾的青蒿素(如图) 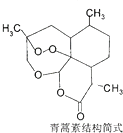 ,分子式是C15H20O5
,分子式是C15H20O5
C.有机物 ![]() 可发生加成反应、氧化反应、还原反应和聚合反应
可发生加成反应、氧化反应、还原反应和聚合反应
D.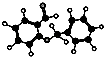 右图所示的有机物分子式为C14H12O2 , 不能发生银镜反应
右图所示的有机物分子式为C14H12O2 , 不能发生银镜反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)![]() CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
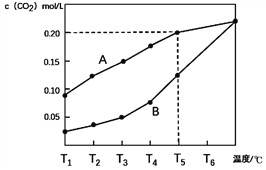
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)CaCO3(s)![]() CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
(2)在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为____克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为____克。
(3)请说明随着温度升高,曲线B向曲线A逼近的原因____
(4)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。
相关主要反应如下:
I. C(s) + H2O(g)![]() CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -43 kJ·mol-1
CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g)![]() CaCO3(s) △H = -178. 3 kJ·mol-1
CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s)![]() CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=____
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s)![]() CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
A. 适当的降低体系的温度 B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气 D. 增加CaO的量
(5)将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03moL·L-1,水的pH约等于6,这种情况下钙离子最大浓度为____moL·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9,碳酸K1=4.3×10-7 K2=4.7×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是( )
A. 该反应方程式中,x=1 B. 2 min时,A的物质的量为0.75 mol
C. 2 min时,A的转化率为50% D. 反应速率v(B)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
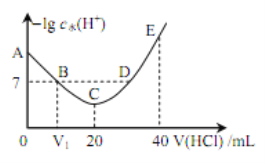
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
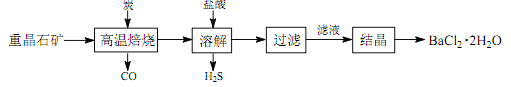
(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
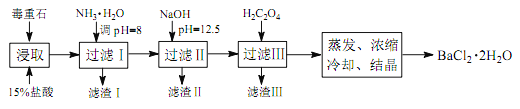
已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列化学反应方程式:
(1)乙烯通入溴水中:
(2)2﹣氯丙烷与氢氧化钠水溶液共热:
(3)乙醇和乙酸在浓硫酸作用下反应:
(4)苯酚与甲醛在加入浓盐酸作用下发生缩聚反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( ) 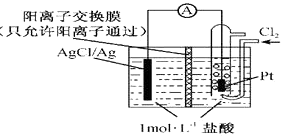
A.正极反应为AgCl+e﹣=Ag+Cl﹣
B.放电时,交换膜左侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01mole﹣时,交换膜左侧溶液中约减少0.01mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com