
【物质结构与性质】
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素
组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的
二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为______,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个σ键, 个π键。
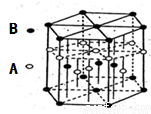
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
(1)N>O>S
(2) 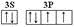
(3)[Cu(NH3)4]SO4?H2O。 sp3杂化
(4)H2O与H2O2之间形成氢键
(5)H-N=N-H;3;1
(6)CuH 2CuH+3Cl2 2CuCl2+2HCl
2CuCl2+2HCl
【解析】某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1,其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4?H2O。
(1)同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S。
(2)D为S元素,其原子的最外层电子排布图为  。
。
(3)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4?H2O,配体为NH3,N原子价层电子对数=3+(5?1×3)/2=4,N原子采取sp3杂化。
(4)O元素可与H元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,则为H2O、H2O2,两种化合物可任意比互溶,其主要原因为:H2O与H2O2分子之间存在氢键。
(5)H元素与N元素可形成分子式为N2H2的化合物,该化合物的分子具有平面结构,N原子之间形成N=N双键,N原子与H原子之间形成N-H键,其结构式为H-N=N-H,分子中含有3个σ键,1个π键。
(6)H元素与Cu元素可形成一种红色化合物,由晶体结构单元可知,4个H原子位于内部,6个H原子位于棱上,晶胞中H原子数目=4+6×1/3=6,3个Cu原子为内部,2个位于面心、12个位于顶点,故晶胞中Cu原子数目=3+2×1/2+12×1/6=6,故该化合物的化学式为CuH,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,应生成CuCl2、HCl,反应方程式为:
2CuH+3Cl2 2CuCl2+2HCl。
2CuCl2+2HCl。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列事实不能用金属活动性解释的是
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C .工业上常用热还原法冶炼铁,用电解法冶炼钠
.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是
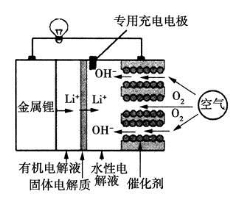
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
下列离子方程式书写正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4NH3·H2O===AlO2-+4NH4+ +2H2O
B.乙酸钠溶液显碱性的原因:CH3COO-+H2O===CH3COOH+OH-
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-===SO32- +H2O
D.漂白粉放置在空气中变质:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:简答题
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
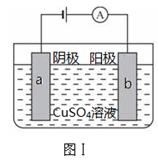
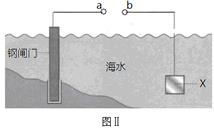
A、图Ⅰ中a为纯铜
B、图Ⅰ中SO42-向b极移动
C、图Ⅱ中如果a、b间连接电源,则a连接负极
D、图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
某温度下,将溶质质量分数为a%的KOH溶液蒸发掉m g水后恢复至原温度,恰好得到质量分数为2a%的KOH饱和溶液V mL,则下列说法中正确的是
A.该温度下KOH的溶解度为100a/(100-a)g
B.原溶液的质量为2m g
C.可以求算原溶液的物质的量浓度
D.保持温度不变,向原溶液中加入2a g KOH可达饱和
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列条件下,离子能大量共存或者离子方程式正确的是( )
A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42-
B、在含较多Al3+的溶液中:K+、Cl-、HCO3-
C、一小块钠投入到CuSO4溶液中:2Na+Cu2+= Cu+2Na+
D、铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2++ 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:推断题
【有机物化学基础】
某有机物X的相对分子质量小于100,取1 mol有机物X在O2中完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L。
(1)该有机物X的分子式为________(填序号)。
A C4H8 B C2H4O C C4H8O2 D C10H20O20
(2)甲物质是X的同分异构体,分子中含有羰基和羟基,甲物质能发生如图所示的转化:
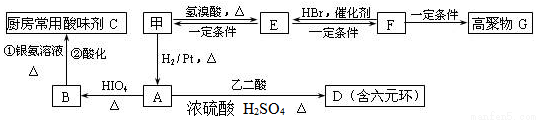
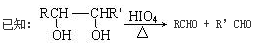
①B的名称是________。与A官能团相同的同分异构体共有______种(包括A但不含立体异构,已知同一个碳上有两个羟基的有机物不稳定)
②A→D的反应类型为________,E→F的反应条件是________。
③写出F→G的化学方程式__________________________________。
(3)物质乙也是X的同分异构体,1 mol乙与足量的Na反应可生成1 mol H2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积之比为2∶1∶1。物质乙的结构简式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com