
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ�

��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ��_______________��
��2�����ӽ���Ĥ������Ϊ��__________��___________��
��3�����Ʊ���ʳ��ˮ��ͼ��______λ�ò��䣬����������Һ��ͼ��_____λ��������ѡ�a������b������c����d������
���𰸡� 2NaCl��2H2O![]() 2NaOH��H2����Cl2�� ��ֹOH��������������Cl2��������Ӧ��2NaOH��Cl2==NaCl��NaClO��H2O ��ֹ����������Cl2������������H2��Ϸ�����ը a d
2NaOH��H2����Cl2�� ��ֹOH��������������Cl2��������Ӧ��2NaOH��Cl2==NaCl��NaClO��H2O ��ֹ����������Cl2������������H2��Ϸ�����ը a d
����������1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ��2NaCl��2H2O![]() 2NaOH��H2����Cl2������2�������������ɵ�����������������Һ�е���������Ӧ���������ӽ���Ĥ������Ϊ��ֹOH��������������Cl2��������Ӧ��2NaOH��Cl2==NaCl��NaClO��H2O��ͬʱҲ��ֹ����������Cl2������������H2��Ϸ�����ը����3��������������������ӷŵ磬��˾��Ʊ���ʳ��ˮ��ͼ��aλ�ò��䣻�����������������ƣ�������������Һ��ͼ��dλ��������
2NaOH��H2����Cl2������2�������������ɵ�����������������Һ�е���������Ӧ���������ӽ���Ĥ������Ϊ��ֹOH��������������Cl2��������Ӧ��2NaOH��Cl2==NaCl��NaClO��H2O��ͬʱҲ��ֹ����������Cl2������������H2��Ϸ�����ը����3��������������������ӷŵ磬��˾��Ʊ���ʳ��ˮ��ͼ��aλ�ò��䣻�����������������ƣ�������������Һ��ͼ��dλ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ��磬�����ڷǵ���ʵ���
A. H2SO4 B. Cl2 C. NaAlO2 D. SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��Y��Zת����ϵ��ͼ��ʾ�������ж���ȷ����(����)

A. X�����ǽ���ͭ B. Y������������
C. Z�������Ȼ��� D. Z��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ұ�����(G)��һ�ֿ�����ʧ��ҩ���������·�ߺϳɣ�
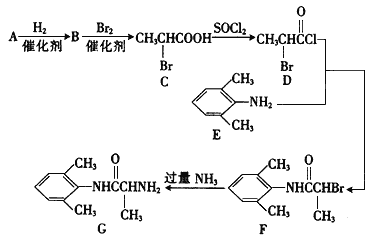
I.(1)��֪A��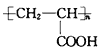 �ĵ��壬��A�����������ŵ�������____________��
�ĵ��壬��A�����������ŵ�������____________��
(2)д��B�Ľṹ��ʽ����ϵͳ��������C������ B��_____________, C�����ƣ�____________��
(3)L��E��ͬ���칹�壬L�����к��б������ұ�����һ�ȴ���ֻ�����֣���L���п��ܵĽṹ��ʽ��![]() ��__________________��
��__________________��
(4)F ��G�ķ�Ӧ������_______________��
(5)���й����Ұ�����(G)��˵����ȷ����____________��
a.�ܷ����ӳɷ�Ӧ b.��ʹ���Ը��������Һ��ɫ
c.�������ᷴӦ������ d.���ڰ�����
(6)д��C������NaOH����Һ����ʱ��Ӧ�Ļ�ѧ����ʽ��______________��
II. H��C��ͬϵ���˴Ź��������������塣������·�ߣ���H�ɺϳɸ߾���V��
![]()
(7)H�Ľṹ��ʽΪ_________________��N��Q�ķ�Ӧ����Ϊ________________��
(8)д��Q��V�ķ�Ӧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na��Mg��Al���й����ʵ�������ȷ���ǣ�
A. ���ԣ�NaOH< Mg(OH)2< Al(OH)3 B. ��һ�����ܣ�Na< Mg <Al
C. �縺�ԣ�Na> Mg >Al D. ��ԭ�ԣ�Na> Mg >Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��⣨ICl���Ļ�ѧ���ʸ��������ƣ�Ԥ������ˮ��Ӧ������������ǣ� ��
A. HI��HClOB. HCl��HIO
C. HClO3��HIOD. HClO��HIO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��F����װ�ã���ͼ��ʾ��(���������ܿ�����ѡ��)


��1��д���١������������ƣ���__________����__________����________����________��
��2��ʵ������ȡ���ռ�����ʱӦѡ��________��________�����ӣ���ȡ���ռ�����ʱӦѡ��________��________�����ӡ�
��3����ľ̿��ԭ����ͭ���������������ʵ�飬Ӧѡ��________��________�����ӣ���������ʱ�۲쵽��ʵ��������__________________________________________________��
��4����ȡ����������ԭ����ͭ��ʵ�飬Ӧѡ��________��________װ�ã�ʵ�����ʱӦ��ֹͣ���ȣ����Թ���ȴ����ֹͣͨ��������ԭ����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1,2-���ȱ���(CH2ClCHClCH3)����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ���������Ҫ������Ϊ3-�ȱ�ϩ(CH2=CHCH2C1) ����Ӧԭ��Ϊ
i. CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ��H1= -134 kJ mol-1
CH2ClCHClCH3(g) ��H1= -134 kJ mol-1
ii. CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ��H2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ��H2= -l02 kJ mol-1
��֪����ػ�ѧ���ļ����������±���ʾ��
��ѧ�� | C��C | C��C | C��Cl | Cl��Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
��ش��������⣺
��1���ɷ�Ӧi���������x=_____________��
��2��һ���¶��£��ܱ������з�����Ӧi�ͷ�Ӧii���ﵽƽ�������ѹǿ��CH2C1CHC1CH3�IJ���____________���������С�����䡱����������_________________________________��
��3��T1��ʱ����10L���ݵ��ܱ������г���1 mol CH2=CHCH2C1��2 mol HC1��ֻ������ӦCH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ��H3��5min��Ӧ�ﵽƽ�⣬��� 05 min�ڣ���CH2ClCHClCH3��ʾ�ķ�Ӧ���� v(CH2ClCHClCH3)=0.016 mol��L-1 min-1��
CH2ClCHClCH3(g) ��H3��5min��Ӧ�ﵽƽ�⣬��� 05 min�ڣ���CH2ClCHClCH3��ʾ�ķ�Ӧ���� v(CH2ClCHClCH3)=0.016 mol��L-1 min-1��
��ƽ��ʱ��HCl���������Ϊ__________________(������λ��Ч���֣���
�ڱ��������������䣬6 minʱ����������г���0. 6 mol CH2=CHCH2Cl��0.2molHC1��0.1mol CH2ClCHClCH3������ʼ��Ӧ���� v��(HCl)______________ ���>����<����=����V��(HCl).
��4��һ��ѹǿ�£����ܱ������г���һ������CH2=CHCH3��C12������Ӧii������ʼ��![]() =w��ƽ��ʱCl2���������(��)���¶�(T)��w�Ĺ�ϵ��ͼ����ʾ��W=1ʱ�������淴Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ����ʾ��
=w��ƽ��ʱCl2���������(��)���¶�(T)��w�Ĺ�ϵ��ͼ����ʾ��W=1ʱ�������淴Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ����ʾ��
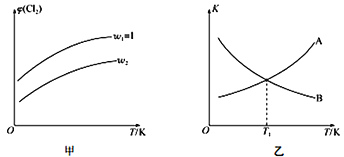
��ͼ���У�w2__________���>����<����=����1
��ͼ���У���ʾ����Ӧƽ�ⳣ��������Ϊ____________���A����B����������Ϊ________________��
��T1K�£�ƽ��ʱa(Cl2)= ________________��
��5����ʼʱ��ij���ݾ��������г���1 mol CH2 =CHCH3��1 mol Cl2������Ӧii���ﵽƽ��ʱ������������ѹǿ_________________���������С�����䡱����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com