
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii. CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C—C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为__________________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的![]() =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
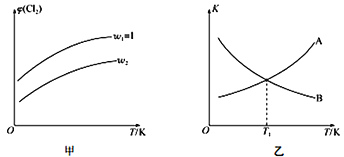
①图甲中,w2__________(填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为____________(填“A”或“B”),理由为________________。
③T1K下,平衡时a(Cl2)= ________________。
(5)起始时向某恒容绝热容器中充入1 mol CH2 =CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
【答案】 332 增大 增大压强,反应ii的平衡不移动,反应i的平衡正向移动。所以CH2C1CHC1CH3的产率增大 54.5% > > B 反应ii的正反应为放热反应。温度升高, 正反应的平衡常数减小 50% 增大
【解析】这是考查化学反应原理的的题目,考查热化学,化学键,化学平衡等知识点。
(1) 由 反 应 i ,ΔH1 = -134 k J· mol -1 =611k J·mol -1 + 243k J·mol -1- x - 2×328k J·mol -1,
解得x=332k J·mol -1。
(2)反应ii的左右两边气体分子总数相等,平衡不受压强影响;反应i为 气 体 分 子 总 数 减 小 的 反 应,增大压强,平衡正向移动,CH2ClCHClCH3 的产率增大。
(3)①0~5m i n内,用 CH2ClCHClCH3 表示的反应速率v(CH2ClCHClCH3)=0.016mol·L-1·m i n -1,平衡时生成 CH2ClCHClCH3的物质的量为0.8mol,则平衡时 HCl (g)的物质的量为1.2mol; 再用差量法计算出平衡时气体总物质的量为 3 mo l-0.8mo l= 2.2 mol,所以 HCl的 体 积 分 数 为![]() 54.5%。 ②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2Cl(g)、HCl(g)、CH2ClCHClCH3(g)的浓度分别为 0. 02 mo l· L-1、0.12mo l·L-1、
54.5%。 ②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2Cl(g)、HCl(g)、CH2ClCHClCH3(g)的浓度分别为 0. 02 mo l· L-1、0.12mo l·L-1、
0.08mo l·L-1,则 平 衡 常 数![]() ;
;
6m i n时的浓度商![]() ,平衡正向移动,所以v正 (HCl )>v逆 (HCl )。
,平衡正向移动,所以v正 (HCl )>v逆 (HCl )。
(4) ① 由 反 应 ii 和 图 甲 知, 一 定 温 度 下, 起 始 的![]() 越大,平衡时 Cl2 的体积分数越小。
越大,平衡时 Cl2 的体积分数越小。
②反应i i的正反应方向为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。 ③由图乙知,温度为T1 时,正、逆反应的平衡常数相等,又因为二者互为倒数,则平衡常数 K=1。 w=1时,设 CH2 =CHCH3 和Cl2 的物质的量均为a mol,参加反应的 Cl2 的物质的量为b mol,利用三段式可列关系式: ![]() ,解得
,解得![]() 。
。
(5)该反应为反应前后气体分子总数相等的放热反应,反应向正反应方向进行,体系温度升高,气体膨胀,压强增大。


科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:

(1)电解饱和食盐水的化学方程式是_______________。
(2)离子交换膜的作用为:__________、___________。
(3)精制饱和食盐水从图中______位置补充,氢氧化钠溶液从图中_____位置流出(选填“a”、“b”、“c”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最新报导的高超导体中,铊(Tl)是其中之一,已知位于第六周期第ⅢA族,关于铊的说法,可能错误的是:
A. 是银白色金属 B. Tl(OH)3有两性
C. 与稀盐酸反应生成盐酸盐 D. 铊的金属性强于铝的金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油裂解、煤的气化、海水制镁等过程中都包含化学变化
B. 可电解熔融MgCl2来制取金属镁,也能电解熔融AlCl3来制取铝
C. 铝热剂、盐酸、水玻璃、过氧化氢、明矾均为混合物
D. Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 氯化铁溶液中加入铜粉:Fe3+Cu=Fe2++Cu2+
B. 将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C. 少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 少量AlCl3溶液滴入过量氨水中:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2能使溴水、KMnO4水溶液褪色
B.可以用澄清石灰水鉴别SO2与CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通入浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com