
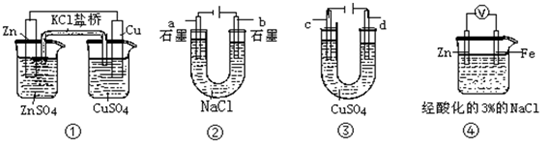
| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②在电解开始阶段,b极附近溶液的pH增大 | |
| C. | 可以用装置③在银上镀铜,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
分析 A、原电池中阳离子向正极移动;
B、b与电源的正极相连,是阳极,开始阶段是氯离子放电生成氯气,而a极是阴极是氢离子放电生成氢气,溶液的pH变大;
C、铜离子在阴极放电生成单质铜,所以镀件在阴极;
D、锌比铁活泼,所以负极是活泼的锌而不是铁.
解答 解:A、装置①原电池中,Zn是负极,Cu是正极,电解质里的阳离子K+移向正极,即移向硫酸铜溶液,故A错误;
B、在装置②电解池中,阴极a极是氢离子发生得电子生成氢气的还原反应,该极附近碱性增强,所以a极附近溶液的pH增大,故B错误;
C、铜离子在阴极放电生成单质铜,所以镀件在阴极,所以c极为银,故C正确;
D、在该原电池中,电子从负极Zn即流向正极Fe极,在铁电极上氢离子得电子生成氢气,反应实质是金属锌和氢离子之间的反应,不会产生亚铁离子,故D错误;
故选C.
点评 本题考查学生原电池的工作原理,注意教材知识的灵活应用,属于基础知识的综合考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苹果酸是一种常见的有机酸,其结构简式如图
苹果酸是一种常见的有机酸,其结构简式如图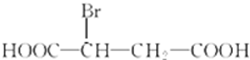 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$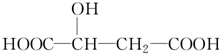 +HBr.
+HBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com