
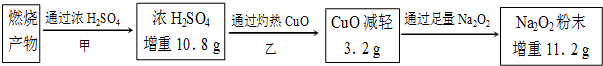
分析 浓硫酸增重10.8g为燃烧生成水的质量,根据n=$\frac{m}{M}$计算水的物质的量;剩余气体通过灼热氧化铜粉末,固体质量减轻3.2g,说明燃烧产物中有CO,发生反应CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2,将最后气体通过足量的过氧化钠粉末时,发生反应2CO2+Na2O2=2Na2CO3+O2,根据差量法计算二氧化碳的总物质的量,再利用原子守恒确定分子式.
解答 解:①浓硫酸作用是:吸水,作干燥剂,故答案为:吸水,作干燥剂;
②Na2O2粉末的作用是:吸收CO2气体,故答案为:吸收CO2气体;
③剩余气体通过灼热氧化铜粉末,固体质量减轻3.2g,说明燃烧产物中有CO,发生反应CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2,现象为:黑色粉末变红色,故答案为:黑色粉末变红色;
④浓硫酸增重10.8g为燃烧生成水的质量,水的物质的量=$\frac{10.8g}{18g/mol}$=0.6mol,故n(H)=0.6mol×2=1.2mol;
剩余气体通过灼热氧化铜粉末,固体质量减轻3.2g,说明燃烧产物中有CO,发生反应CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2,将最后气体通过足量的过氧化钠粉末时,固体质量又增加了11.2g,则:
2CO2+Na2O2=2Na2CO3+O2,固体质量增加△m
2mol 2×44g-32g=56g
n(CO2) 11.2g
所以,2mol:n(CO2)=56g:11.2g,解得n(CO2)=0.4mol,
根据原子守恒可知烃中N(C)=$\frac{0.4mol}{0.2mol}$=2,N(H)=$\frac{1.2mol}{0.2mol}$=6,故该烃的分子式为:C2H6,
故答案为:C2H6.
点评 本题考查有机物分子式的确定,难度不大,氧化铜固体质量变化为干扰信息,若按部就班进行解答,增大计算量,注意元素守恒法在判断有机物的分子式中的运用.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果、蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过500g | |
| C. | 要促进身体健康,饮食必须合理搭配 | |
| D. | 鸡蛋含有丰富的蛋白质,人体所需的蛋白质可由鸡蛋提供,青少年可适当多吃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
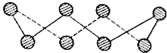 (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
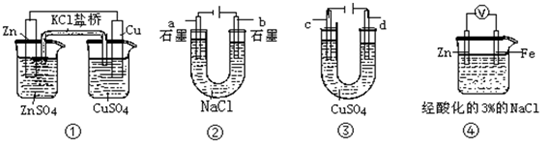
| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②在电解开始阶段,b极附近溶液的pH增大 | |
| C. | 可以用装置③在银上镀铜,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol H2O2 | B. | 0.5mol H2SO4 | C. | 1mol HNO3 | D. | 1.5mol He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g Mg | B. | 2.7g Al | C. | 2.4 g Mg | D. | 2.8g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液、KOH溶液、K2SO3溶液、KI溶液 | |
| B. | 苯酚溶液、CCl4溶液、氯水、氨水 | |
| C. | 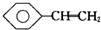 、CH3-C≡CH、福尔马林、乙醛 、CH3-C≡CH、福尔马林、乙醛 | |
| D. | NaOH溶液、FeCl2溶液、亚硫酸溶液、KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com