
【题目】下列离子方程式正确的是( )
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B.尼泊金酸(![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对沉淀溶解平衡的描述正确的是( )
A. 反应开始时,溶液中各离子浓度相等
B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
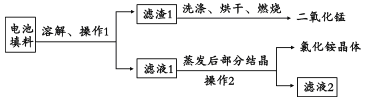
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
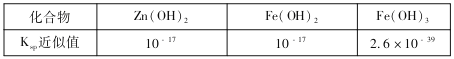
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层。
(1)基态C原子核外有_____种运动状态不同的电子,元素C的气态氢化物的空间构型为____。
(2)B、C、D三种元素的第一电离能由大到小的顺序为_________。(用元素符号表示)
(3)A与B形成的化合物B2A2中B原子的杂化方式为____,分子中含有的σ键和π键个数分别是______、_______。
(4)D与钠元素形成的原子数之比为l:1的物质中具有的化学键类型为______。
(5)E+与C的简单离子形成晶体的晶胞结构如图1所示,图中白球表示_______。
(6)E的单质晶体的晶胞结构如图2所示,其空间利用率为_____(圆周率用π表示,![]() )
)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是____________.调pH的最适宜范围为_______________
(2) 调PH过程中加入的试剂最好是_________
A.NaOH B.CuO C.NH3 ﹒H2O D.Cu2(OH)2CO3
(3)煮沸CuSO4溶液的原因是_____________________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式________________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________________。
(5) 称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol﹒L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol﹒L-1的Ce((SO4)2溶液滴定,到达终点时消耗Ce((SO4)2溶液25.00 mL。有关的化学反应为 Fe3++CuCl=Fe2++Cu2++Cl-, Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;B称作冰片,可用于医药和制香精,樟脑等;C的核磁共振氢谱显示其分子中含有4种氢原子;D中只含一个氧原子,与Na反应放出H2;F为烃。仔细阅读以下转化关系:
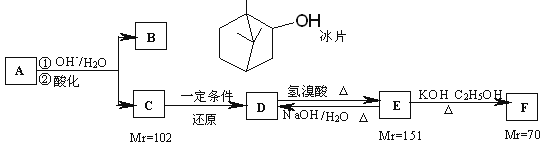

回答以下问题:
(1)B的分子式为__________。
(2)B不能发生的反应是___________(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应
(3)E→F的反应类型是____________。
(4)F的分子式为_________,化合物H是F的同系物,相对分子质量为56,H所有可能的结构有______种。
(5)用系统命名法给F命名的名称为______________。
(6)写出E→D的化学力程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1 mol能和2 mol HCl加成得到饱和产物,其饱和产物又能和6 mol Cl2完全取代,则该烃是
A. C2H6 B. C2H2 C. C3H4 D. C4H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com