
【题目】A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层。
(1)基态C原子核外有_____种运动状态不同的电子,元素C的气态氢化物的空间构型为____。
(2)B、C、D三种元素的第一电离能由大到小的顺序为_________。(用元素符号表示)
(3)A与B形成的化合物B2A2中B原子的杂化方式为____,分子中含有的σ键和π键个数分别是______、_______。
(4)D与钠元素形成的原子数之比为l:1的物质中具有的化学键类型为______。
(5)E+与C的简单离子形成晶体的晶胞结构如图1所示,图中白球表示_______。
(6)E的单质晶体的晶胞结构如图2所示,其空间利用率为_____(圆周率用π表示,![]() )
)

【答案】 7 三角锥形 N>O>C SP 3 2 离子键 非极性共价键 N3+ ![]()
【解析】试题分析:本题为《物质结构与性质》选修模块综合测试题,涉及元素推断、原子结构和元素周期律,分子结构和晶胞计算,题目难度中等。
解答:根据题意知A与B能形成种类繁多的化合物,则A为氢元素,B为碳元素;D原子中成对电子数等于未成对电子数的3倍,电子排布式为1s22s22p4,D为氧元素;C的核电荷数介于碳和氧之间,则C为氮元素;E+中所有电子正好充满K、L、M三个电子层,则E为钾元素。
(1)C为氮元素,基态氮原子核外有7种运动状态不同的电子,NH3分子中含有3个δ键,氮原子上含有一对孤对电子,空间构型为三角锥型。
(2)同周期由左向右元素的第一电离能呈递增趋势,但氮原子的价电子排布式为2s22p3,p轨道为半充满状态,较稳定,故C、N、O三种元素的第一电离能由大到小的顺序为N>O>C 。
(3)乙炔分子的结构简式为![]() ,分子中含有碳碳三键,C原子的杂化方式为sp;分子单键均为σ键,三键中有1个σ键、2个π键,分子中含有的σ键和π键个数分别是3、2。
,分子中含有碳碳三键,C原子的杂化方式为sp;分子单键均为σ键,三键中有1个σ键、2个π键,分子中含有的σ键和π键个数分别是3、2。
(4)氧元素与钠元素形成的原子数之比为l:1的物质为Na2O2,具有的化学键类型为离子键和非极性键。
(5)K+与N3-形成化合物的化学式为K3N,根据晶胞结构利用分割法分析:白球个数为8×1/8=1,黑球个数为12×1/4=3,则图中白球表示N3-。
(6)钾的单质晶体的晶胞结构为面心立方堆积,设晶胞的棱长为a,则面对角线为√2a,则钾原子半径为r=√2a/4,利用切割法分析1个晶胞中含有4个钾原子,则钾原子的体积为4×4πr3/3 ,晶胞的体积为a3,结合题给公式![]() 计算其空间利用率为
计算其空间利用率为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
A.提出了元素周期律
B.开发了合成氨的生产工艺
C.揭示了燃烧的本质
D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
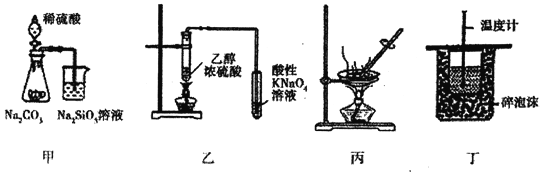
A. 图甲装罝可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B.尼泊金酸(![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Na+、Al3+、Cl-、SO42- B. Cu2+、Cl-、NO3-、OH-,
C. Ca2+、Na+、CO32-、NO3- D. H+、SO42-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. Cl2 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
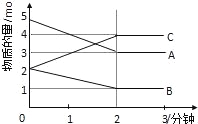
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体).
(1)该反应的化学方程式为 ;
(2)反应开始至2分钟时,B的平均反应速率为 .
(3)能说明该反应已达到平衡状态的是 .
a.v(A)=2v(B)
b.容器内压强保持不变
c.v逆(A)=v正(C)
d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com