
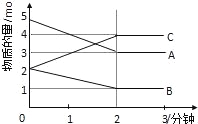
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体).
(1)该反应的化学方程式为 ;
(2)反应开始至2分钟时,B的平均反应速率为 .
(3)能说明该反应已达到平衡状态的是 .
a.v(A)=2v(B)
b.容器内压强保持不变
c.v逆(A)=v正(C)
d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为 .
【答案】(1)2A+B2C;
(2)0.1mol/(L.min);
(3)bc;
(3)40%.
【解析】
试题分析:(1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)根据平衡状态的判断标志可以作出判断;
(4)根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得转化率.
解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C,
故答案为:2A+B2C;
(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为![]() =0.1mol/(L.min),
=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(3)a、v(A)=2v(B)不能说明正反应和逆反应的关系,故无法判断反应是否达到平衡,故a错误;
b、该反应为前后气体体积变小的反应,随着正反应的进行,气体物质的量不断减小,压强也减小,当压强不变时,说明反应已达平衡状态,故b正确;
c、在该反应中A和C的计量数相等,所以当v逆(A)=v正(C)时,可以说明反应已达平衡状态了,故c正确;
d、该反应在5L恒容容器中进行,所有物质又都是气体,所以反应体系的密度始终不变,所以不能作为平衡状态的判断标志,故d错误;
故答案为:bc;
(3)由图可知:达平衡时,△n(A)=2mol,所以A的转化率为![]() ×100%=40%;
×100%=40%;
故答案为:40%.


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层。
(1)基态C原子核外有_____种运动状态不同的电子,元素C的气态氢化物的空间构型为____。
(2)B、C、D三种元素的第一电离能由大到小的顺序为_________。(用元素符号表示)
(3)A与B形成的化合物B2A2中B原子的杂化方式为____,分子中含有的σ键和π键个数分别是______、_______。
(4)D与钠元素形成的原子数之比为l:1的物质中具有的化学键类型为______。
(5)E+与C的简单离子形成晶体的晶胞结构如图1所示,图中白球表示_______。
(6)E的单质晶体的晶胞结构如图2所示,其空间利用率为_____(圆周率用π表示,![]() )
)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
![]()
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1 mol能和2 mol HCl加成得到饱和产物,其饱和产物又能和6 mol Cl2完全取代,则该烃是
A. C2H6 B. C2H2 C. C3H4 D. C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为 ,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,回答下列问题:
(1)醋酸的电离方程式是 ;
在0.1mol·L﹣1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
(2)向醋酸中加入醋酸钠固体,电离平衡 移动(填向左、向右或不变,下同);c(H+) (填增大、减小或不变,下同),pH (填增大、减小或不变,下同)
(3)向醋酸中加入碳酸钙固体,电离平衡向 移动;c(CH3COOH) .
(4)向醋酸中加入大量的水,c(OH﹣) .导电能力 ,电离平衡常数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体应用与其性质的对应不正确的是( )
A.鉴别胶体与浊液(丁达尔效应) B.高压除尘(电泳现象)
C.河海交汇处可沉积沙洲(聚沉) D.喷雾剂的应用(布朗运动)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com