
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
![]()
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
【答案】(l)防止Fe2+被氧化为Fe3+,(2分)
(2)c(SO42-)>c(NH4-)>c(Fe2+)>c(H+)>c(OH-)(2分)
(3)2×10-5(2分)
(4)MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;(2分)
滴入最后一滴高锰酸钾溶液,锥形瓶内溶液由浅绿色变为浅紫色,且30s不变色;(2分)
![]() ×100%(2分)BC(2分)
×100%(2分)BC(2分)
【解析】
试题分析:(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
(2)Fe2+水解,NH4+水解,溶液呈酸性,两者的浓度降低,溶液中离子浓度由大到小的顺序为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
(4)常温下,若0.10 molL-1(NH4)2SO4溶液的pH=5,溶液中c(H+)=10-5molL-1,故溶液中c(OH-)=10-9molL-1,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5molL-1=10-9molL-1+0.20 molL-1,则c(NH4+)=(0.20+10-9-10-5)molL-1,根据物料守恒计算溶液中c(NH3H2O)=0.20molL-1-(0.20+10-9-10-5)molL-1=(10-5-10-9)molL-1,故NH4++H2O![]() NH3H2O+H+的平衡常数的表达式为
NH3H2O+H+的平衡常数的表达式为![]() =
= ![]() =5×10-10,氨水中存在下列的电离平衡:NH3H2O
=5×10-10,氨水中存在下列的电离平衡:NH3H2O![]() NH4++OH-,电离平衡常数为K,水的电离平衡可知:5×10-10×K=1×10-14,所以K=2×10-5;
NH4++OH-,电离平衡常数为K,水的电离平衡可知:5×10-10×K=1×10-14,所以K=2×10-5;
(4)利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+↑1,Mn由+7价→+2↓5,最小公倍数5,根据原子个数、电荷守恒,即MnO4-+5Fe2++ 8H+=Mn2+ + 5Fe3++ 4H2O;向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:滴入最后一滴高锰酸钾溶液,锥形瓶内溶液由浅绿色变为浅紫色,且30s不变色;因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为(25.02+24.98)mL÷2=25mL,根据离子反应方程式,得出:n[((NH4)2SO4·FeSO4·6H2O]=5n(KMnO4)=25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4·FeSO4·6H2O]=25×10-3×c×5×500/25mol=2.5cmol,所以质量分数=2.5c×392/a×100%=980c/a×100%;A、俯视读数,造成所读的数偏小,A错误;B、滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,B正确;C、锥形瓶用待测液润洗,待测液的物质的量增加,则消耗高锰酸钾的体积增加,C正确;D、三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,D错误,答案选BC。


科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
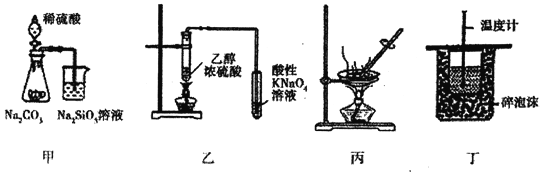
A. 图甲装罝可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. Cl2 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届山东省临沂市高三上学期期末考试】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【辽宁省大连市2017届高三3月双基测试】下列化学用语正确的有
①乙酸的最简式:CH2O ②二氧化硅的分子式:SiO2
③HClO的结构式:H—Cl—O ④乙烯是结构简式:CH2CH2
⑤Cl-的结构示意图: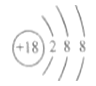
⑥过氧化钠的电子式:
⑦H2CO3的电离方程式:H2CO3![]() H++HCO3-
H++HCO3-
⑧吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述中正确的是( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能使紫色石蕊溶液先变红后褪色
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
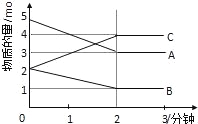
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体).
(1)该反应的化学方程式为 ;
(2)反应开始至2分钟时,B的平均反应速率为 .
(3)能说明该反应已达到平衡状态的是 .
a.v(A)=2v(B)
b.容器内压强保持不变
c.v逆(A)=v正(C)
d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A![]() H++HA—;
H++HA—;
HA—![]() H++A2—;
H++A2—;
已知同温同浓度时的电离平衡常数K(H2A)远大于K(HA—),设有下列四种溶液体系:
A. 0.01 mol/L的H2A溶液
B. 0.01 mol/L的NaHA溶液
C. 0.02 mol/L的盐酸与0.04 mol/L的NaHA溶液等体积混合液
D. 0.02 mol/L的氢氧化钠溶液与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)H+浓度最大的是 ,最小的是 。
(2)H2A浓度最大的是 ,最小的是 。
(3)A2— 浓度最大的是 ,最小的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
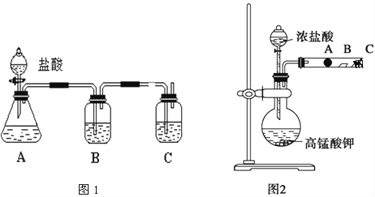
(1)甲同学设计实验的理论依据是_____________________________________;
写出选用药品分别为:A____________,B__________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验理论依据是______________________________________;
A处的现象是: ___________________________________________;
写出B处的离子方程式_____________,C处药品的作用 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com