
【题目】下列关于硝酸的叙述中正确的是( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能使紫色石蕊溶液先变红后褪色
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
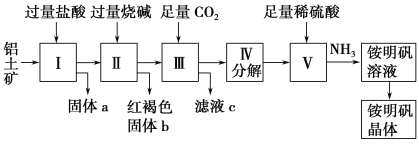
请回答下列问题:
(1)固体a的化学式为 ,Ⅲ中通入足量CO2气体发生反应的离子方程式为 。
(2)由Ⅴ制取铵明矾溶液的化学方程式为 ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1 L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市红桥区2017届高三上学期期末考试】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化的表达合理的是
A.向0.lmol/L、pH=l的NaHA 溶液中加入 NaOH 溶液:HA-+OH-=A2-+H2O
B.标准状况下,将1.12LCO2气体通入lL0.lmol/L的NaA1O2溶液中:
CO2+2H2O+A1O2-=A1(OH)3↓+HCO3-
C.由水电离出的c(H+)=1×1012mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
D.向NH4A1(SO4)2溶液中滴加 Ba(OH)2溶液使 SO42-完全沉淀:
NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
![]()
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数. | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是( )
A.30℃,块状锌与2 molL-1硫酸溶液反应
B.30℃,粉末状铁与2 molL-1硫酸溶液反应
C.60℃,粉末状锌与2 molL-1硫酸溶液反应
D.60℃,粉末状镁与2molL-1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为 ,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL酸式滴定管中盛有盐酸,液面恰好在a mL刻度处,把管内液体全部放入量筒内,所得液体的体积一定 ( )
A. 等于a mL B. 等于(50-a)mL C. 大于(50-a)mL D. 大于a mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com