
【题目】【天津市红桥区2017届高三上学期期末考试】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】
A、H2S是二元弱酸,H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,c(H+)> c(HS-),故错误;B、NH3·H2O是弱碱,部分电离,稀释10倍,促进电离,pH应是a-1<b<a,故错误;C、按照电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故错误;D、依据越弱越水解,酸性:CH3COOH>H2CO3>HClO,因此水解程度:ClO->HCO3->CH3COO-,因此相同pH时,c(CH3COONa)>c(NaHCO3)>c(NaClO),因此c(Na+):①>②>③,故正确。离子浓度大小是高考的高频题,几乎每年都会涉及,此类题题目,往往从以下几个角度考虑:(1)电离理论,①弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中c(NH3·H2O)>c(OH-)>c(NH4+),②多元弱酸的电离是分步进行的,其主要是第一级电离;(2)水解理论,①弱离子的水解损失是微量(双水解除外),但由于水的电离,因此水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度,如NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O),②多元弱酸根离子的水解是分步的,其主要是第一步水解;(3)电荷守恒→注重溶液呈中性,特别注意前面的系数;(4)物料守恒→注重溶液中某元素的原子守恒;(5)质子守恒→注重分子或离子得失H+数目不变;对酸式根离子是电离还是水解,结合题目信息进行处理;解决此类问题要头脑冷静,结合掌握知识细心推断,见到等号,立即想到三个守恒的思想。
H++S2-,c(H+)> c(HS-),故错误;B、NH3·H2O是弱碱,部分电离,稀释10倍,促进电离,pH应是a-1<b<a,故错误;C、按照电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故错误;D、依据越弱越水解,酸性:CH3COOH>H2CO3>HClO,因此水解程度:ClO->HCO3->CH3COO-,因此相同pH时,c(CH3COONa)>c(NaHCO3)>c(NaClO),因此c(Na+):①>②>③,故正确。离子浓度大小是高考的高频题,几乎每年都会涉及,此类题题目,往往从以下几个角度考虑:(1)电离理论,①弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中c(NH3·H2O)>c(OH-)>c(NH4+),②多元弱酸的电离是分步进行的,其主要是第一级电离;(2)水解理论,①弱离子的水解损失是微量(双水解除外),但由于水的电离,因此水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度,如NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O),②多元弱酸根离子的水解是分步的,其主要是第一步水解;(3)电荷守恒→注重溶液呈中性,特别注意前面的系数;(4)物料守恒→注重溶液中某元素的原子守恒;(5)质子守恒→注重分子或离子得失H+数目不变;对酸式根离子是电离还是水解,结合题目信息进行处理;解决此类问题要头脑冷静,结合掌握知识细心推断,见到等号,立即想到三个守恒的思想。


科目:高中化学 来源: 题型:
【题目】(17分)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
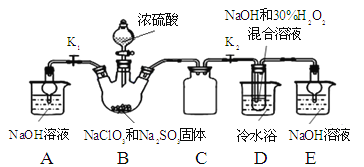
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【贵州省贵阳市2017届高三2月适应性考试(一)】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
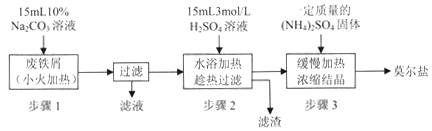
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. Cl2 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | R |
利用表中元素回答下列问题:
(1)X元素在周期表中的位置为__________。
(2)气态氢化物水溶液呈碱性的元素是_____________,此氢化物的电子式__________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)![]() 和
和![]() 是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则
是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则![]() 的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体中相对分子质量较大的气体的分子式及物质的量为__________、_____________,生成硫酸铜的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届山东省临沂市高三上学期期末考试】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述中正确的是( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能使紫色石蕊溶液先变红后褪色
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com