
(14分)H2O2的水溶液是一种常用的杀菌剂,其质量百分比一般为3%和30%。
1-1 在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式 。
1-2 分别写出实验室、老工业、新工业制备H2O2的三种方法。
1-3 写出二种定量测定H2O2水溶液中H2O2含量的化学方程式和简要实验步骤。
1-4 将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲学生认为这是由于H2O2是二元弱酸,消耗了OH-,而使红色褪去;乙学生认为,H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位学生的解释中哪种正确?
1-1 酸性溶液中:2Fe(CN)64-+H2O2+2H+=2Fe(CN)63-+2H2O
碱性溶液中:2Fe(CN)63-+H2O2+2OH-=2Fe(CN)64-+2H2O+O2↑(2分)
1-2 实验室:BaO2+2CO2+2H2O=Ba(HCO3)2+H2O2(2分)
老工业:2NH4HSO4![]() (NH4)2S2O8+H2↑
(NH4)2S2O8+H2↑
(NH4)2S2O8+H2O=2NH4HSO4+H2O2 (2分)
新工业: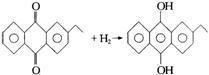
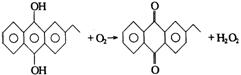 (2分)
(2分)
1-3 ①用标准KMnO4溶液滴定H2O2水溶液:
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O(2分)
②H2O2水溶液中加入过量KI溶液,再用标准Na2S2O3溶液进行滴定:
H2O2+2I-+2H+=I2+2H2O I2+2S2O32-=2I-+S2O42-(2分)
1-4 向褪色后的溶液中加入少量氢氧化钠溶液使溶液显碱性,如果溶液变红,说明甲学生的解释正确;反之,说明乙学生的解释正确。(2分)


科目:高中化学 来源: 题型:
[化学—选修化学与技术]
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
![]() 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为
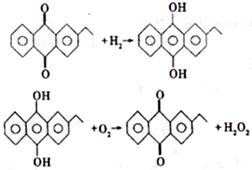
乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修化学与技术](15分)
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
![]() 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为
乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)纳米材料二氧化钛(TiO2)可做优良的催化剂.
据报道:“生态马路”是在铺设时加入一定量的TiO2, TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
①b中破坏的是__________ (填“极性共价键”或“非极性共价键”).
②H2O2能清除路面空气中的等,其主要是利用了 H2O2的作用是_____________________________________________(填“氧化性”或“还原性”).
(2)某固体混合物中含有Na+、K+、Mg2+和Cl-、Br-五种微粒.
I.欲将钠、钾、镁三元素大致分离开来,并将氯、溴两元素大致分离开来,有以下方法和操作步骤可供选择(其中有的步骤可选两次).
①溶于水制成稀溶液;②溶于水制成浓溶液;③通入足量CO2;④加入足量氯水;
⑤通入足量氨气; ⑥过滤; ⑦用四氯化碳萃取.
选取最合理的方法和步骤:(按顺序先后填写编号) .
II.分离后剩余的水溶液中所含的主要物质是 .
III.在上述分离过程中分离出一种化合物晶体.欲得到干燥的该化合物固体,有两种方法可供选择:①.加热蒸发掉水分;②.将过滤得到的固体物质自然风干.正确的方法应选择______________________________________________.
查看答案和解析>>
科目:高中化学 来源:哈师大附中、东北师大附中、辽宁省2010年高三第二次联考(理综)化学部分 题型:填空题
[化学—选修化学与技术] (15分)
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极: ;
阳极: ;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为

乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com