
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
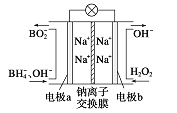
A. 该电池的负极反应为BH4-+8OH--8e-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 每消耗3 mol H2O2,转移的电子为3 mol
D. 电极a采用MnO2作电极材料
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:

②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___(任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___(填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___。
(5)“赶氨”时,最适宜的操作方法是___。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。

回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。

(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__molL-1(填实验现象再加热C装置)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
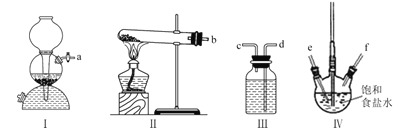
A.实验时装置I产生的气体应先通人到装置IV中
B.装置II中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置IV内会出现浑浊现象
查看答案和解析>>
科目:高中化学 来源: 题型:
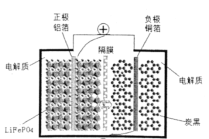
【题目】完成下列电化学习题:
(1)某电池工作时的总反应可简化为:![]() ,电池中的固体电解质可传导Li+,则放电时,正极的电极反应式为________。充电时,Li+迁移方向为____(填“由左向右”或“由右向左”),图中聚合物隔膜应为____(填“阳”或“阴”)离子交换膜。
,电池中的固体电解质可传导Li+,则放电时,正极的电极反应式为________。充电时,Li+迁移方向为____(填“由左向右”或“由右向左”),图中聚合物隔膜应为____(填“阳”或“阴”)离子交换膜。
(2)使用间接电解法可处理燃煤烟气中的NO,装置如下图左。已知电解池的阴极室中溶液在pH在4~7(酸性)之间,试写出阴极的电极反应式______;用离子方程式表示吸收塔中除去NO的原理________。

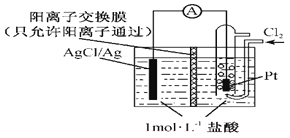
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。则负极反应为_______,放电时交换膜右侧溶液中酸性____(填“增强”、“减弱”或“不变”),若用KCl溶液代替盐酸,则电池总反应______(填“改变”或“不变”)。
(4)在生产和生活中采取了多种防止金属腐蚀的措施,利用原电池原理保护金属的方法是_______。
(5)纯锌与酸反应,为什么加入少许硫酸铜后会加速反应_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3.已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题
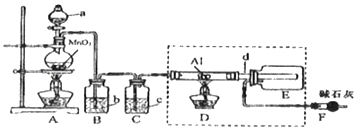
(1)仪器a中所装试剂名称为_____。
(2)B装置的作用为_____。
(3)能否省去C装置_____(填“能”或“否”),理由是_____(用化学方程式表示)。
(4)所用d导管较粗的原因是_____。
(5)F中碱石灰的作用为_____(填字母)。
a.吸收Cl2 b.吸收HCl c.吸收CO2 d.吸收H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是
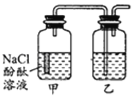
A. 乙中导气管里形成一段水柱B. 乙中导气管中产生气泡
C. 金属片剪口处溶液变红D. 锌被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com