
【题目】铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀。已知铬在自然界最重要的矿物是铬铁矿![]() 或
或![]() ,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。
,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。
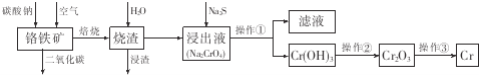
![]() 如果在实验室模拟操作
如果在实验室模拟操作![]() ,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
![]() 完成流程图中铬铁矿焙烧时的化学反应方程式______。
完成流程图中铬铁矿焙烧时的化学反应方程式______。
![]() 重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含
重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含![]() 废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:
废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:![]() 若某一时间段内溶液中减少了
若某一时间段内溶液中减少了![]() ,则这段时间电路中至少转移了______mol电子
,则这段时间电路中至少转移了______mol电子

![]() 已知:
已知:
![]() 时
时![]() 溶液中仅存在两种含铬离子
溶液中仅存在两种含铬离子![]() 、
、![]() ,在溶液中存在:
,在溶液中存在:
![]() 黄色
黄色![]() 橙色
橙色![]()
![]()
![]() 时,
时,![]() 易溶于水,
易溶于水,![]() 难溶于水,且
难溶于水,且![]()
Ⅰ![]() 第
第![]() 步反应的下列状态一定达到平衡的是______
步反应的下列状态一定达到平衡的是______
![]() 和
和![]() 的浓度相同
的浓度相同
![]()
![]() 溶液的颜色保持不变
溶液的颜色保持不变
Ⅱ![]() 若将
若将![]() 的
的![]() 溶液和一定浓度的硝酸等体积混合,充分混合后溶液的
溶液和一定浓度的硝酸等体积混合,充分混合后溶液的![]() ,则此时溶液中两种含铬离子浓度之比
,则此时溶液中两种含铬离子浓度之比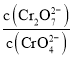 的近似值______,取此混合液1ml与
的近似值______,取此混合液1ml与![]() 的
的![]() 溶液混合,试判断混合溶液______
溶液混合,试判断混合溶液______![]() 填“能”或“不能”
填“能”或“不能”![]() 生成沉淀。
生成沉淀。
【答案】沿玻璃棒向过滤器中加水至浸没沉淀,待水自然流尽后重复![]() 次
次 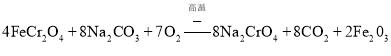 变性
变性 ![]() c
c ![]() 能
能
【解析】
铬铁矿组成为![]() 或
或![]() ,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成
,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成![]() 和
和![]() ,熔渣A为
,熔渣A为![]() 、
、![]() ,熔渣溶于水后过滤得滤渣为
,熔渣溶于水后过滤得滤渣为![]() ,滤液为
,滤液为![]() 溶液,向
溶液,向![]() 溶液中加硫化钠还原得到
溶液中加硫化钠还原得到![]() ,
,![]() 受热分解生成
受热分解生成![]() ,然后用铝热反应制得Cr。铬铁矿组成为
,然后用铝热反应制得Cr。铬铁矿组成为![]() 或
或![]() ,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成
,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成![]() 和
和![]() ,熔渣A为
,熔渣A为![]() 、
、![]() ,熔渣溶于水后过滤得滤渣为
,熔渣溶于水后过滤得滤渣为![]() ,滤液为
,滤液为![]() 溶液,向
溶液,向![]() 溶液中加硫化钠还原得到
溶液中加硫化钠还原得到![]() ,
,![]() 受热分解生成
受热分解生成![]() ,然后用铝热反应制得Cr。
,然后用铝热反应制得Cr。
![]() 根据洗涤沉淀的操作分析;
根据洗涤沉淀的操作分析;
![]() 在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成
在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成![]() 和
和![]() ;
;
![]() 重铬酸钾能使蛋白质发生变性;根据化合价的变化计算转移电子;
重铬酸钾能使蛋白质发生变性;根据化合价的变化计算转移电子;
![]() 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度保持不变;
反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度保持不变;
![]() 在溶液中存在:
在溶液中存在:![]() 黄色
黄色![]() 橙色
橙色![]() ,则
,则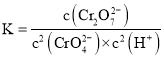 ,据此计算;根据
,据此计算;根据![]() 与
与![]() 计算。
计算。
铬铁矿组成为![]() 或
或![]() ,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成
,在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成![]() 和
和![]() ,熔渣A为
,熔渣A为![]() 、
、![]() ,熔渣溶于水后过滤得滤渣为
,熔渣溶于水后过滤得滤渣为![]() ,滤液为
,滤液为![]() 溶液,向
溶液,向![]() 溶液中加硫化钠还原得到
溶液中加硫化钠还原得到![]() ,
,![]() 受热分解生成
受热分解生成![]() ,然后用铝热反应制得Cr。
,然后用铝热反应制得Cr。
![]() 实验室洗涤沉淀的操作是:沿玻璃棒向过滤器中加水至浸没沉淀,待水自然流尽后重复
实验室洗涤沉淀的操作是:沿玻璃棒向过滤器中加水至浸没沉淀,待水自然流尽后重复![]() 次。答案为:沿玻璃棒向过滤器中加水至浸没沉淀,待水自然流尽后重复
次。答案为:沿玻璃棒向过滤器中加水至浸没沉淀,待水自然流尽后重复![]() 次;
次;
![]() 在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成
在碳酸钠熔融条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成![]() 和
和![]() ,反应的方程式为:
,反应的方程式为: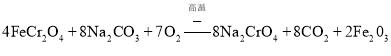 。答案为:
。答案为: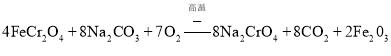 ;
;
![]() 重铬酸钾具有强氧化性,能使蛋白质发生变性,鞣革过程中,生皮中蛋白质发生了变性;
重铬酸钾具有强氧化性,能使蛋白质发生变性,鞣革过程中,生皮中蛋白质发生了变性;![]() 反应中消耗
反应中消耗![]() 转移6mol电子,所以溶液中减少了
转移6mol电子,所以溶液中减少了![]() 时,转移电子为
时,转移电子为![]() 。答案为:变性;
。答案为:变性;![]() ;
;
![]() 和
和![]() 的浓度相同,不一定是平衡状态;
的浓度相同,不一定是平衡状态;![]() ,平衡前,不管反应进行到什么程度,都有此关系,不一定是平衡状态;
,平衡前,不管反应进行到什么程度,都有此关系,不一定是平衡状态;![]() 溶液的颜色保持不变,即是
溶液的颜色保持不变,即是![]() 的浓度保持变化,故c正确。答案为:c;
的浓度保持变化,故c正确。答案为:c;
![]() 在溶液中存在:
在溶液中存在:![]() 黄色
黄色![]() 橙色
橙色![]() ,则
,则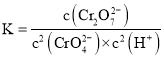 ,
,![]() 的
的![]() 溶液和一定浓度的硝酸等体积混合,充分混合后溶液的
溶液和一定浓度的硝酸等体积混合,充分混合后溶液的![]() ,则
,则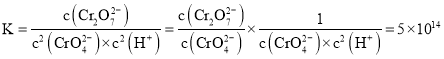 ,则
,则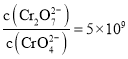 ;
;
![]() ,所以能形成沉淀。
,所以能形成沉淀。
故答案为:![]() ;能。
;能。


科目:高中化学 来源: 题型:
【题目】向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如下图所示。
则下列说法正确的是( )
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b—c段与c—d段溶液中阴离子的物质的量相等
C.在d点,向溶液中加入盐酸,沉淀量将减少
D.在反应过程中,各状态点溶液的pH大小顺序是:e > d > c > a > b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大.金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是它的电子层数的2倍。下列说法正确的是![]()
A.金属W具有两性
B.X、Z形成的化合物为离子化合物
C.Y与Z生成的化合物在水中会发生双水解
D.元素X与氢形成的原子个数比为1:1的化合物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于难溶盐MX,其饱和溶液中M+和X-浓度之间的关系为Ksp=c(M+)c(X-),现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是( )
①20mL0.01molL-1KCl溶液;②30mL0.02molL-1CaCl2溶液;③40mL0.03molL-1HCl溶液;④10mL蒸馏水;⑤50mL0.05molL-1AgNO3溶液
A.①>②>③>④>⑤B.④>①>③>②>⑤
C.⑤>④>②>①>③D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g) ![]() 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
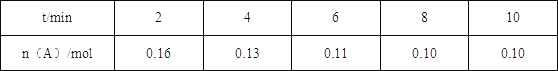
A.反应前2min的平均速率ν(C)=0.02molL﹣1min﹣1
B.平衡后降低温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴环己烯(![]() )可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
)可与下列4种物质发生反应:①HBr、②酸性高锰酸钾溶液、③氢氧化钠的水溶液、④氢氧化钠的乙醇溶液。下列有关这些反应的说法中正确的是( )
A.与①反应后的有机产物只有一种
B.与②的反应原理类似于烯烃使溴水褪色
C.与③反应后得到的有机产物可被氧化为醛
D.与④反应后得到的有机产物只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式为( )
A.浓盐酸与铁屑反应:2Fe+6H+=2 Fe3++3H2↑
B.钠与 CuSO4 溶液反应: 2Na + Cu2+ = Cu 2Na
C.足量Na2CO3溶液中清入几滴稀H2SO4 :![]() + 2H+ = H2O + CO2
+ 2H+ = H2O + CO2
D.向 FeCl3 溶液中加入铜粉: Cu + 2Fe3+ = 2Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实,某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
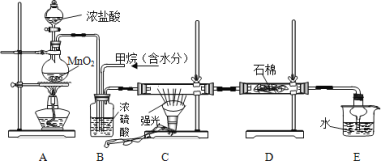
请回答:
(1)B 转置有两种功能:①干燥混合气体;②_____。
(2)D 转置的石棉中含有均匀混合了 KI 的淀粉糊,反应进行一段时间后其现象是_____。
(3)在 C 装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色固体小颗粒产生,你猜测生成黑色小颗粒的化学方程式可能是:_____。
(4)E 装置除吸收了 HCl 外,还含有有机物,从 E 中分离出盐酸的最佳方法为_____。该装还有缺陷, 原因是没有进行尾气处理,其尾气主要成分为_____(填序号)。
a.CH3Cl b.CH2Cl2 c.CHCl3 d.CCl4 e.CH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com