
【题目】根据能量图,下列说法正确的是

A.A2(g)+B2(g)=2AB(g)是一个放热反应
B.2AB(g)=A2(g)+B2(g) ΔH=-(a-b) kJ·mol-1
C.拆开1 mol AB(g)中的化学键需要吸收b kJ的能量
D.1 mol A2(g)和1 mol B2(g)的能量之和为a kJ
【答案】B
【解析】
A.由于生成物的能量比反应物高,故发生的反应A2(g)+B2(g)=2AB(g)为吸热反应,A错误;
B.根据图示可知A2(g)+B2(g)=2AB(g)为化合反应,1 mol A2(g)和1 mol B2(g)反应产生2 molAB(g)吸收(a-b) kJ的热量,则2 molAB(g)分解产生1 mol A2(g)和1 mol B2(g)放出热量是(a-b) kJ,其热化学方程式为:2AB(g)=A2(g)+B2(g) ΔH=-(a-b) kJ·mol-1,B正确;
C.根据图示:拆开2 mol AB(g)中的化学键需要吸收b kJ的能量,则拆开1 mol AB(g)中的化学键需要吸收![]() kJ的能量,C错误;
kJ的能量,C错误;
D.断裂1 mol A2(g)中 A-A键和1 mol B2(g)中的B-B键,形成2 mol A(g)和2 mol B(g)原子需吸收的能量之和为a kJ,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.氢氧燃料电池的能量转换形式仅为化学能转化为电能
B.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率
C.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
D.在一密闭容器中发生2SO2+O2![]() 2SO3反应,增大压强,平衡会正向移动,
2SO3反应,增大压强,平衡会正向移动,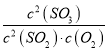 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断正确的是( )
A.反应①、②属于氧化还原反应,③属于非氧化还原反应
B.Y的离子半径比Z的离子半径小
C.反应③可以证明X的非金属性强于W
D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4= FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A_______B_______(填“能”或“不能”)
(2)根据下图填空

①负极为___________,该电极的方程式为__________________
②正极的现象是________________________________,发生____________________反应(填写“氧化”或“还原”)
③电子从_____经导线流向_______,溶液中H+向________移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.1mol·L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大②[NH3·H2O]增大③![]() 数目增多④[OH-]增大⑤导电性增强⑥
数目增多④[OH-]增大⑤导电性增强⑥![]() 增大⑦
增大⑦![]() 减小
减小
A.①②③B.①③⑤C.①③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
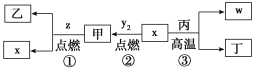
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
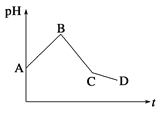
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气脱硝脱碳的主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。在一定温度下,体积固定为2L的密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表所示:
时间/s | c(NO)/(mol·L-1) | c(CO)/(mol·L-1) |
0 | 9.50×10-3 | 9.00×10-3 |
1 | 4.50×10-3 | 4.00×10-3 |
2 | 2.50×10-3 | 2.00×10-3 |
3 | 1.50×10-3 | 1.00×10-3 |
4 | 1.50×10-3 | 1.00×10-3 |
下列说法正确的是
A.前2 s内的平均反应速率v(N2)=3.5×10-3mol·L-1·s-1
B.升高温度时,逆反应速率增大,正反应速率减小
C.容器内气体压强不再发生变化时,反应达到平衡状态
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
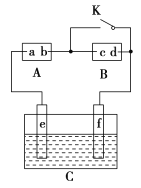
(1)电源A中a为________极。
(2)滤纸B上发生的总反应方程式为:______________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:______________,电极f上发生的反应为:______________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com