
 A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:
A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:

 ,故答案为:
,故答案为: ;
;
| ||


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:山东省东营市胜利第二中学2011届高三上学期期中学段考试化学试题 题型:022
(Ⅰ)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是________
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅱ)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填编号).
①单质
②氧化物
③电解质
④盐
⑤化合物
(2)一种无色透明溶液中
,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:①将溶液滴在蓝色石蕊试纸上,呈红色.
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色.
③取少许溶液滴入BaCl2试液,则产生白色沉淀.
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀.
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是________;肯定存在的离子是________;不能作出判断的离子是________.
查看答案和解析>>
科目:高中化学 来源:2012届贵州省凯里一中高三第二次月考理综合测试(化学部分) 题型:填空题
(16分)下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。
回答下列问题:
(1)A的电子式为 ;B分子属于 分子(极性、非极性);
(2)反应①的化学方程式为 ,
反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L。
(4)检验K中阳离子常用的方法是 。
(5)L浓溶液的保存方法是 。
查看答案和解析>>
科目:高中化学 来源:2012届北京市海淀区高三上学期期中练习化学试卷 题型:填空题
(12分)已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。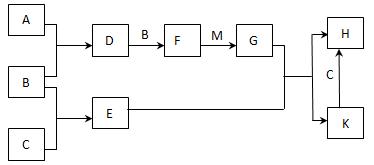
请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 B. 还原性 C. 漂白性
(4)C与M在一定条件下反应的化学方程式为 。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品 吨。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)(2分)下列操作会导致实验结果偏高的是
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
(Ⅱ)(2分)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B. 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅲ)、离子反应是中学化学中重要的反应类型,回答下列问题:
(1)(2分)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)(6分)一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 ;不能作出判断的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com