
| A. | K+、Na+、SiO32-、Cl- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | Na+、CO32-、SO32- SO42- | D. | Na+、S2-、OH-、Cl- |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于净水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | 氯元素在自然界主要以氯气形式存在 | |
| D. | 氯气被广泛用于医药合成、农药生产等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| D. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
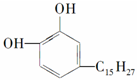 ②白藜芦醇
②白藜芦醇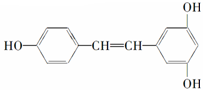
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
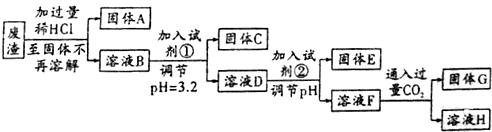
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com