
【题目】下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:
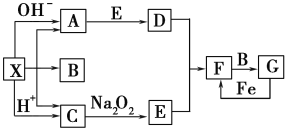
(1)化学式X____________,A__________,B________。
(2)实验室收集气体D和F的方法依次是____________法、__________法。
(3)写出C→E的化学反应方程式_____________________________。
(4)请写出A与E反应生成D的化学方程式____________________________。
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
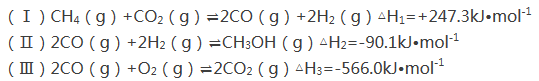
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为![]() ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于DNA与RNA的叙述,正确的是( )
A. 在细胞内存在的主要部位相同 B. 构成的五碳糖不同
C. 核苷酸之间的连接方式不同 D. 构成的碱基相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65 kJ的热量。
(1)写出肼和过氧化氢的结构式:肼____________过氧化氢____________。
(2)写出反应的热化学方程式:__________________________。
(3)已知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体个很突出的优点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.共价化合物中不可能含有离子键
B.H2O比H2S稳定,H—S键比H—O键更难断裂
C.最外层只有一个电子的原子与卤素原子形成的化学键可能是离子键,也可能是共价键
D.离子键和共价键的实质都是电性的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是
A.“O”既可以表示宏观上的氧元素,也可以表示微观的一个氧原子
B.烧碱、纯碱按物质分类都属于碱
C.氧气、臭氧均为氧单质,所以物理性质、化学性质完全相同
D.泡沫灭火器的灭火原理是降低了可燃物的着火点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
![]()
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸240ml。
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的____________。

(2)选用的主要仪器有:__________
①烧杯,②玻璃棒,③量筒,④胶头滴管,⑤____________。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至凹液面恰好与刻度线相切
D.稀释浓H2SO4
E.将冷却后的稀释液转入容量瓶
F.将蒸馏水注入容量瓶,直到液面距刻度线1-2cm处
G.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀,其操作正确的顺序依次为____________________________。
(4)简要回答下列问题:
①所需浓硫酸的体积为____________mL,如果实验室有10mL、20mL、50mL的量筒应选用____________mL的量筒最好
②下列操作使所配溶液浓度偏高的是__________
A.用水洗涤量取浓硫酸的量筒,并将洗涤液转入容量瓶中
B.用量筒来量取浓硫酸,读数时,俯视量筒
C.搅拌过程中有液体溅出
D.在转入容量瓶前烧杯中液体未冷却至室温
E.定容时,俯视刻度线
F.容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人生病时要合理用药。下列药品与其作用不匹配的是
A. 氢氧化铝:中和过多胃酸 B. 阿司匹林: 解热镇痛
C. 青霉素:消炎抗菌 D. 医用碘酒:人体补碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com