
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
分析 短周期元素中,B有最低负价-4,C有最高正价+4,二者处于IVA族,且C的原子半径比B的大,故B为碳元素、C为Si;四元素原子最外层电子数之和为19,则A与D原子的最外层电子数之和为19-4-4=11,可知A、D的最外层电子数只能是5和6,而原子半径A>Si>碳>D,四种元素均有相同的化合价应为+4价,可知A为S元素、D为N元素.
解答 解:短周期元素中,B有最低负价-4,C有最高正价+4,二者处于IVA族,且C的原子半径比B的大,故B为碳元素、C为Si;四元素原子最外层电子数之和为19,则A与D原子的最外层电子数之和为19-4-4=11,可知A、D的最外层电子数只能是5和6,而原子半径A>Si>碳>D,四种元素均有相同的化合价应为+4价,可知A为S元素、D为N元素.
(1)A为S元素,在元素周期表中的位置为:第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)含N元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为:NH3+HNO3═NH4NO3,
故答案为:NH3+HNO3═NH4NO3;
(3)D的最高价氧化物对应的水化物为硝酸,碳能与浓硝酸在加热条件下发生反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;
(4)Si与NaOH溶液反应的化学方程式:Si+2NaOH+H2O═Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O═Na2SiO3+2H2↑;
(5)硫、碳、硅、氮均可形成分子中含18电子的氢化物,这些氢化物的分子式分别为:H2S、C2H6、SiH4、N2H4,
故答案为:H2S、C2H6、SiH4、N2H4.
点评 本题考查结构性质位置关系、元素化合物组成与性质,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握,抓住短周期元素进行推断,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 甘油是油脂的一种 | |
| B. | 油脂中均含有酯基 | |
| C. | 油脂不能发生取代反应 | |
| D. | 油脂在酸性条件下的水解程度比碱性条件下大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g | B. | 4.4 g | ||
| C. | 5.6 g | D. | 在2.8 g和5.6 g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
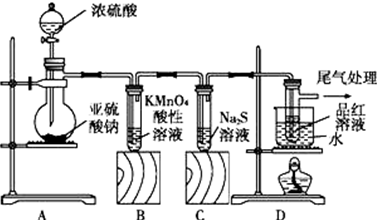
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
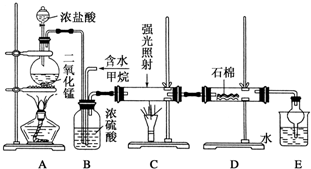
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com