
分析 (1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,否则不能设计成原电池;
(2)非氧化还原反应不能设计成原电池;
(3)根据Cu+2Ag+═2Ag+Cu2+可知Fe应为负极,失电子被氧化,正极可为C、Ag等,正极上Ag+得电子生成Ag,电解质溶液含有Ag+.
解答 解:(1)A.该反应不是氧化还原反应,所以不能设计成原电池,B.该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:A不能,B能;
(2)A.NaOH+HCl═NaCl+H2O该反应中各元素的化合价不变,属于复分解反应,所以不是氧化还原反应,则不能设计成原电池,
故答案为:A为非氧化还原反应,没有电子的转移;
(3)Cu+2Ag+=Cu2++2Ag,根据反应前后的金属单质确定电极材料,所以该原电池的电极材料是铜和碳,铜易失去电子发生氧化反应,所以铜作负极,电极反应式为:Cu-2e-=Cu2+,Ag(石墨、Pt、等只要比Cu不活泼且能导电即可)作正极发生还原反应,2Ag++2e-=2Ag;
故答案为:铜;Cu-2e-=Cu2+;氧化反应;Ag(石墨、Pt、等只要比Cu不活泼且能导电即可);2Ag++2e-=2Ag;还原反应.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大.
注意原电池的设计:
1、基本方法
以氧化还原反应为基础,确定原电池的正负极、电解质溶液及电极反应,可参考锌-铜-稀硫酸原电池模型处理问题.其方法是还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.
2、电解质溶液的选择
电解质溶液一般要能与负极发生反应,或者是电解质溶液中溶解的其它物质与负极发生反应.
3、电极材料的选择
电极材料必须导电,负极必须能够与电解质溶液反应,容易失去电子;正极和负极之间只有产生电势差,电子才能定向运动,所以正极和负极不用同一种材料.


科目:高中化学 来源: 题型:选择题
| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数呈周期性变化 | B. | 元素的相对原子质量逐渐增大 | ||
| C. | 核电荷数逐渐增大 | D. | 核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
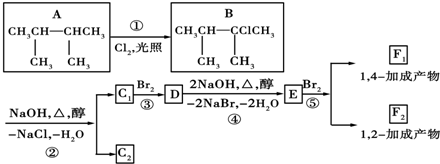
 .
. ;F1的结构简式是
;F1的结构简式是 .F1与F2的关系为同分异构体.
.F1与F2的关系为同分异构体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com