
| A. |  | B. |  | C. |  | D. |  |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
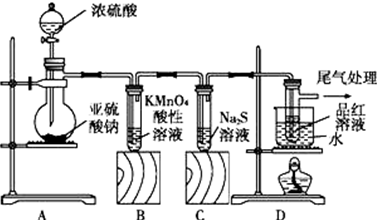
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
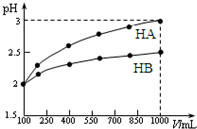 已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.
已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化铜反应:H++OHˉ═H2O | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 澄清石灰中通入过量二氧化碳:Ca2++2OHˉ+CO2═CaCO3↓+H2O | |
| D. | 金属钠跟水反应:2Na+2H2O═2Na++2OHˉ+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com