
| A、容器Ⅰ、Ⅱ中正反应速率相同 | B、容器Ⅰ、Ⅲ中反应的平衡常数相同 | C、容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
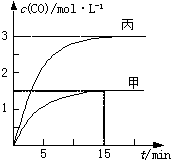 一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O |
1molCO 1molH2 |
4molC 2molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com