
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和④的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号,下同);
(3)⑥的原子结构示意图为_____________;
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与③最高价氧化物的水化物反应的化学方程式:___________________________________;
(5)⑦、⑧的氢化物热稳定性较强的是________(填氢化物化学式)。
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )
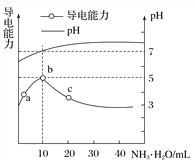
A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.已知:
则可以计算出反应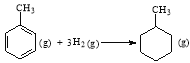 的ΔH为-384 kJ/mol
的ΔH为-384 kJ/mol
B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为:
C8H18(g)+12.5O2(g)=== 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol
C.2CO(g)+O2(g)===2CO2(g) ;ΔH=-566 kJ/mol
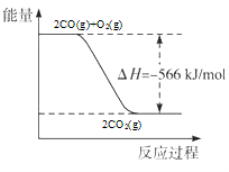
如图可表示该反应过程与能量的关系
D.S(s)+O2(g)===SO2(g);ΔH1
S(g)+O2(g)===SO2(g);ΔH 2 则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:
2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:

A. 若达到平衡时,测得体系放出9. 24 kJ热量,则H2反应速率变化曲线如图a所示
B. 如图b所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92. 4kJ
C. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图c
D. 若起始加入物料为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2OCO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正、逆反应速率均减小
C. 增大C的量,H2O的转化率增大
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g) = 2H2O(1) △H=―571.6kJ/mol![]()
B.2H2(g)+O2(g) = 2H2O(1) △H=+571.6 kJ/mol
C.H2(g)+![]() O2(g) = H2O(g) △H=―285.8 kJ/mol
O2(g) = H2O(g) △H=―285.8 kJ/mol
D.H2(g)+![]() O2(g) = H2O(1) △H=―285.8kJ/mol
O2(g) = H2O(1) △H=―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。盐桥中装有饱和K2SO4溶液,下列叙述中正确的是

A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。根据下表中短周期元素的原子半径和主要化合价,回答表后的问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)上述元素中与元素⑧处于同一周期的有______________________(填元素符号)
(2)元素①在元素周期表中的位置是_______________________
(3)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为__________________(填化学式)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤_____________ ②⑤_____________ ③⑦_____________
(5)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com