
【题目】反应C(s)+H2OCO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正、逆反应速率均减小
C. 增大C的量,H2O的转化率增大
D. 升高温度,平衡向逆反应方向移动
科目:高中化学 来源: 题型:
【题目】I.用惰性电极电解400 mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后。
①若向所得溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中总的离子反应方程式为_________。
②若向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为__________mol。
II.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则电路中共转移____________mol电子,此时铝元素以_____________形式存在。(用化学用语作答)
III.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。
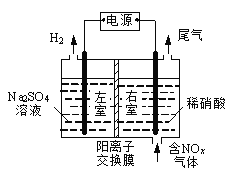
(1) 若用NO2气体进行模拟电解法吸收实验。
① 写出电解时NO2发生反应的电极反应式:__________________。
② 若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+________mol。
(2) 某小组在右室装有10 L 0.2 mol·L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 LH2。原气体中NO和NO2的体积比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是( )
A.第15列元素的最高价氧化物的化学式是R2O3
B.第17列元素单质熔、沸点逐渐升高
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和④的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号,下同);
(3)⑥的原子结构示意图为_____________;
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与③最高价氧化物的水化物反应的化学方程式:___________________________________;
(5)⑦、⑧的氢化物热稳定性较强的是________(填氢化物化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿佛加德罗常数,下列说法正确的是:
A. 14 g 氮气中含有7NA个电子
B. 1 mol Cl2作为氧化剂得到的电子数为NA
C. 标准状况下,2. 24 L的CCl4中含有的C—Cl键数为0. 4NA
D. 常温常压下,3. 0 g含甲醛的冰醋酸中含有的原子总数为0. 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取四个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4∶1)的混合气体、二氧化氮和氧气(体积比为4∶3)的混合气体;然后分别做溶解于水的喷泉实验。实验结束后四个烧瓶中所得溶液的物质的量浓度之比为 ( )
A. 2∶1∶2∶2 B. 5∶5∶5∶4
C. 5∶5∶4∶4 D. 7∶7∶4∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com