
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
【答案】(1)>(2分) (2)减小(2分)(3)bc (2分)(4)c (2分)
【解析】
试题分析:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,没有完全反应,即释放的热量小于完全反应释放的热量,即b<a;
(2)正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小;
(3)a.V(C3)=2V(B2)时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,不能据此判断平衡状态,a错误;b.该反应是一个反应前后气体体积减小的可逆反应,当容器内压强保持不变时,正逆反应速率相等,反应达到平衡状态,b正确;c.V逆(A2)=2V正(B2)=V正(A2),同一物质的正逆反应速率相等,该反应达到平衡状态,c正确;d.混合气体遵循质量守恒定律,则反应前后混合气体质量不变,容器体积不变,则容器内的密度保持不变,不能据此判断平衡状态,d错误;答案选bc;
(4)a.及时分离出C3气体,平衡正向移动,但反应速率减小,a错误;b.适当升高温度反应速率增大但平衡逆向移动,b错误;c.增大B2的浓度,平衡正向移动且反应速率增大,c正确;d.选择高效的催化剂,反应速率增大但平衡不移动,d错误;答案选c。


科目:高中化学 来源: 题型:
【题目】下列能源组合中,均属于新能源的一组是:
①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能
A. ①②③④ B. ①⑤⑥⑦⑧ C. ③④⑥⑧ D. ③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:
2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:

A. 若达到平衡时,测得体系放出9. 24 kJ热量,则H2反应速率变化曲线如图a所示
B. 如图b所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92. 4kJ
C. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图c
D. 若起始加入物料为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2OCO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正、逆反应速率均减小
C. 增大C的量,H2O的转化率增大
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g) = 2H2O(1) △H=―571.6kJ/mol![]()
B.2H2(g)+O2(g) = 2H2O(1) △H=+571.6 kJ/mol
C.H2(g)+![]() O2(g) = H2O(g) △H=―285.8 kJ/mol
O2(g) = H2O(g) △H=―285.8 kJ/mol
D.H2(g)+![]() O2(g) = H2O(1) △H=―285.8kJ/mol
O2(g) = H2O(1) △H=―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实验装置可用于制取乙炔。
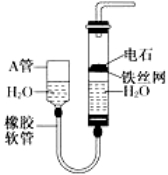
请填空:
(1)图中,A管的作用是____________,制取乙炔的化学方程式是______________。
(2)实验时常滴加饱和食盐水而不直接滴加水,其目的是________________,为了除去反应后的气体杂质,常选用___________试剂。
(3)乙炔通入溴的CCl4溶液中观察到的现象是_____________,乙炔发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。盐桥中装有饱和K2SO4溶液,下列叙述中正确的是

A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组设计的用化学电源使LED灯发光装置。下列说法不正确的是

A. 锌是负极,电子从锌片经导线流向铜片
B. 氢离子在铜片表面被还原
C. 装置中存在“化学能→ 电能→ 光能”的转换
D. 如果将硫酸换成橙汁,导线中不会有电子流动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A. 体积分数为95%的酒精通常作为医用酒精
B. 石油裂解、煤的气化、海水的提镁都包含化学变化
C. 绿色化学的核心是应用化学原理对环境污染进行治理
D. 利用高纯度二氧化硅制造的太阳能电池板可将光能直接转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com