
【题目】下列能源组合中,均属于新能源的一组是:
①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能
A. ①②③④ B. ①⑤⑥⑦⑧ C. ③④⑥⑧ D. ③⑤⑥⑦⑧
科目:高中化学 来源: 题型:
【题目】25℃时,在20 ml 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )
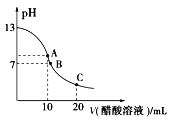
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(Na+)﹦c(CH3COO-)﹥c(OH-)﹦c(H+)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+)﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应2Cu(IO3)2+24KI+12H2SO4==2CuI↓+13I2+12K2SO4+12H2O,当1mol氧化剂参加反应时,被氧化的物质的物质的量为
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用惰性电极电解400 mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后。
①若向所得溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中总的离子反应方程式为_________。
②若向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为__________mol。
II.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则电路中共转移____________mol电子,此时铝元素以_____________形式存在。(用化学用语作答)
III.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。
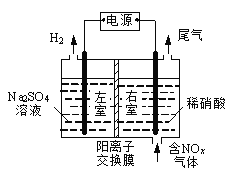
(1) 若用NO2气体进行模拟电解法吸收实验。
① 写出电解时NO2发生反应的电极反应式:__________________。
② 若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+________mol。
(2) 某小组在右室装有10 L 0.2 mol·L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 LH2。原气体中NO和NO2的体积比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的描述不正确的是
A. 氧化铁可制作防锈油漆 B. 碳酸氢钠可制作烘焙糕点的发酵粉
C. 氯气不能用来合成药物,因为它有毒 D. NO能促进血管扩张,防止血管栓塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )


A. 图1所示的装置可用于干燥、收集并吸收多余的氨气
B. 用广泛pH试纸测得0.1mol·L-1NaClO溶液的pH值约为12
C. 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液
D. 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是( )
A.第15列元素的最高价氧化物的化学式是R2O3
B.第17列元素单质熔、沸点逐渐升高
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com