
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
【答案】D
【解析】解:A.10 min内,T1时υ(CH4)= ![]() =0.015molL﹣1min﹣1 , T2时时υ(CH4)=
=0.015molL﹣1min﹣1 , T2时时υ(CH4)= ![]() =0.02molL﹣1min﹣1 , T1时υ(CH4)比T2时小,故A正确;B.温度升高,反应速率加快,因此T2>T1 , 故B正确;
=0.02molL﹣1min﹣1 , T1时υ(CH4)比T2时小,故A正确;B.温度升高,反应速率加快,因此T2>T1 , 故B正确;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故C正确;
D.T1时反应进行的更为彻底,因此平衡常数更大,K(T1)>K(T2),故D错误;
故选:D.
A.由表格中的数据计算υ(CH4);
B.温度升高,反应速率加快;
C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热;
D.T1时反应进行的更为彻底.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.30 g乙烷中所含的极性共价键数为7NA
B.标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C.1 L浓度为1 molL﹣1的 H2O2水溶液中含有的氧原子数为2NA
D.MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣ ![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( ) 
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有混有氯化钠杂质碳酸钠固体,为测定其中碳酸钠的质量分数,设计如下方案:
(1)称取20.0g上述固体,溶于水配成溶液,加入过量的CaCl2溶液,溶液变浑浊,过滤洗涤干燥,得到固体10g,求碳酸钠的质量分数。______________
(2)现取等质量的上述固体,加入过量的盐酸,求生成的气体在标准状况下的体积。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列物质中:①能导电的是________(填代号,以下同);
②属于电解质的是____________;
③属于非电解质的是____________。
A.NaOH溶液 B.Cu C.液态HCl D.蔗糖溶液
E.液氯 F.氨水 G.胆矾晶体 H.无水乙醇
(2)若将0.2mol钠、镁、铝分别投入到100mL1mol·L-1的盐酸中,在标准状况下,产生氢气体积之比是_____________。
(3)取等质量的铁硅合金样品两份,分别投入到足量的稀盐酸和足量的稀氢氧化钠溶液中,充分反应后,收集到等量的氢气,则原合金样品中铁和硅的物质的量之比为______________________。
(4)向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
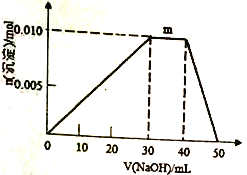
①写出m点反应的离子方程式____________________________________。
②若NH4Al(SO4)2溶液改加20mL1.2mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)在一定条件下,21.6gA单质与1.20molCl2完全反应,生成0.800molAClx,则x= , A的摩尔质量为 .
(2)实验室需要2.0molL﹣1NaOH溶液90mL,用托盘天平称取氢氧化钠,其质量为g;
(3)将5.60g铁投入100mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
①所用盐酸中HCl的物质的量浓度为
②反应中生成的H2在标准状况下的体积为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 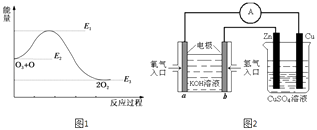
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ═Al(OH)3↓
C. 三氯化铁溶液中加入铁粉: ![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种短周期主族元素aX,bY,cZ.已知a+c=2b,若Z的最高价氧化物对应的水化物是中学常见的强酸,则下列有关说法中正确的是( )
A.若X为O,则Y,X形成的常见化合物一定是离子化合物
B.若X是Na,则Z的最高正价一定是偶数
C.若Y为O,则非金属性:X<Y<Z
D.若Y为Na,则X,Z不可能是同一主族元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com