
【题目】按要求填空:
(1)下列物质中:①能导电的是________(填代号,以下同);
②属于电解质的是____________;
③属于非电解质的是____________。
A.NaOH溶液 B.Cu C.液态HCl D.蔗糖溶液
E.液氯 F.氨水 G.胆矾晶体 H.无水乙醇
(2)若将0.2mol钠、镁、铝分别投入到100mL1mol·L-1的盐酸中,在标准状况下,产生氢气体积之比是_____________。
(3)取等质量的铁硅合金样品两份,分别投入到足量的稀盐酸和足量的稀氢氧化钠溶液中,充分反应后,收集到等量的氢气,则原合金样品中铁和硅的物质的量之比为______________________。
(4)向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
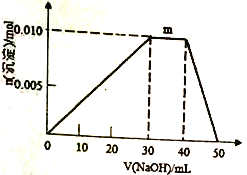
①写出m点反应的离子方程式____________________________________。
②若NH4Al(SO4)2溶液改加20mL1.2mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
【答案】 ABF CG H 2:1:1 2:1 NH4++OH-=NH3H2O 0.022
【解析】(1)①含有自由移动电子或离子的物质可以导电,则能导电的是氢氧化钠溶液、铜、氨水,答案选ABF;②在水溶液里或熔化状态下能够自身电离出离子的化合物的化合物属于电解质,因此属于电解质的是液态HCl、胆矾晶体,答案选CG;③在水溶液里和熔融状态下都不能自身电离出离子的化合物属于非电解质,属于非电解质的是无水乙醇,答案选H。(2)盐酸的物质的量是0.1mol,因此与镁或铝的反应中盐酸不足,金属过量,生成的氢气均是0.05mol;0.2mol钠与盐酸反应时也过量,但过量的钠可以继续与水反应生成氢气,所以钠产生的氢气是0.1mol,因此在标准状况下,产生氢气体积之比是2:1:1。(3)根据电子得失守恒可知铁与盐酸反应:Fe~H2,而硅与氢氧化钠反应:Si~2H2,放出等量的H2,设生成氢的量为2mol,所以粗硅中铁和硅的物质的是之比为:2:1。(4)①由图可知0mL~30mL,发生反应Al3++3OH-=Al(OH)3↓,氢氧化铝沉淀逐渐增多,m点过程中加入氢氧化钠,沉淀物质的量不变,是铵根与氢氧根反应生成NH3H2O,离子方程式为NH4++OH-=NH3H2O,40mL~50mL是氢氧化铝逐渐溶解;②10mL1mol·L-1NH4Al(SO4)2溶液中Al3+物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL1.2mol/LBa(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,由SO42-+Ba2+=BaSO4↓可知SO42-不足,故可以得到0.02mol BaSO4,根据方程式可知
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol
NH4++OH-=NH3H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体的物质的量为0.02mol+0.002mol=0.022mol。


科目:高中化学 来源: 题型:
【题目】铋(Bi)在医药方面有重要应用.下列关于 ![]() Bi和
Bi和 ![]() Bi的说法正确的是( )
Bi的说法正确的是( )
A.![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
B.![]() Bi和
Bi和 ![]() Bi互为同位素
Bi互为同位素
C.![]() Bi和
Bi和 ![]() Bi的核外电子数不同
Bi的核外电子数不同
D.![]() Bi和
Bi和 ![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+、NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]() (不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
下列说法正确的是
A. 该溶液中可能含K+
B. 该溶液中肯定含有NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]()
C. 该溶液中一定不含NO![]()
D. 该溶液中一定含K+,且c(K+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32﹣、Ba2+、SO42﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液,反应后进行( )、( )、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是;
(2)写出实验3中的空格处的实验操作;
(3)根据实验对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围(若“一定不存在”或“不能确定”不填此空).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以正丁醇、溴化钠、硫酸为原料制备正溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下: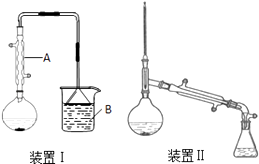
物质 | 正丁醇 | 正溴丁烷 |
沸点/℃ | 117.2 | 101.6 |
熔点/℃ | ﹣89.12 | ﹣112.4 |
密度/gcm﹣3 | 0.8098 | 1.2758 |
溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
将所得粗产品倒入分液漏斗中,先用10mL水洗涤,除去大部分水溶性杂质,然后依次用5mL浓硫酸、10mL水、10mL饱和NaHCO3溶液、10mL水洗涤.分离出有机层,加入无水氯化钙固体,静置1h,过滤除去氯化钙,再常压蒸馏收集99~103℃馏分.
回答下列问题:
(1)仪器A的名称是 , 冷却水从A的(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是(填化学式).本实验使用电热套进行加热,总共使用了次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是 .
(6)本实验得到正溴丁烷6.5g,产率为(只列式,不必计算出结果).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( ) 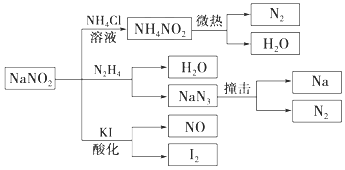
A.NaNO2在水中的溶解性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用KI,淀粉和食醋鉴别NaNO2和NaCl
D.分解NaN3盐每产生1 mol N2 转移6 mol e﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com