
 mL bmol·L
mL bmol·L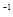 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )| A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解 |
B.若金属全部溶解,则溶液中一定含有Fe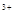 |
C.若金属全部溶解,且产生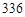 mL气体(标准状况),则b mL气体(标准状况),则b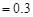 |
D.当溶液中金属离子只有Fe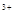 、Cu 、Cu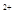 时,则a与b的关系为:b≥ 时,则a与b的关系为:b≥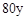 (1 (1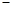 a/3) a/3) |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 |
| B.对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 |
| C.阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH-浓度增大,溶液显碱性,从而使酚酞变红 |
| D.阴极上的电极反应式为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
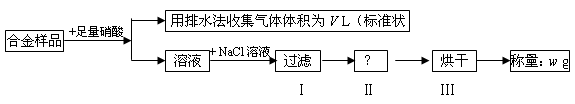
| A.收集到的V L气体为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: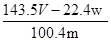 ×100% ×100% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
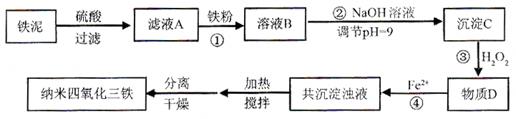
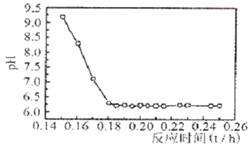
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。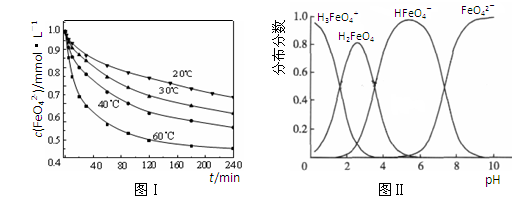

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com