
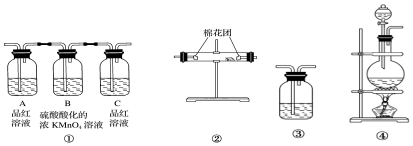
分析 碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,要验证反应产物,应依次通过盛有无水硫酸铜的硬质试管,无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,再通过品红溶液检验二氧化硫存在,二氧化硫具有漂白性能够使品红褪色,要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,再通过品红检验二氧化硫是否吸收完全,最后通入澄清石灰水,如果澄清石灰水变浑浊证明二氧化碳的存在,据此解答.
解答 解:碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,要验证反应产物,应依次通过盛有无水硫酸铜的硬质试管,无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,再通过品红溶液检验二氧化硫存在,二氧化硫具有漂白性能够使品红褪色,要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,再通过品红检验二氧化硫是否吸收完全,最后通入澄清石灰水,如果澄清石灰水变浑浊证明二氧化碳的存在.
(1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)要验证产物,应依次通过盛有无水硫酸铜的硬质试管检验水的存在,再通过品红溶液检验二氧化硫的存在,再通过高锰酸钾溶液除去二氧化硫,再通过品红溶液检验二氧化硫是否除尽,最后通过澄清石灰水,所以正确的顺序为:④②①③;
故答案为:④②①③;
(3)装置气密性检查方法为:关闭分液漏斗活塞,微热烧瓶,③导管口产生气泡,停止加热后③导管中有一段稳定的液柱,则气密性良好;
故答案为:关闭分液漏斗活塞,微热烧瓶,③导管口产生气泡,停止加热后③导管中有一段稳定的液柱,则气密性良好;
(4)二氧化硫具有漂白性,能够使品红溶液褪色,据此检验二氧化硫的存在;要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,二氧化硫具有还原性,能够被高锰酸钾吸收,再通过品红检验二氧化硫是否吸收完全;
故答案为:验证SO2的存在;充分吸收SO2;验证SO2是否已被吸收完全;
(5)无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,据此可以判断水的存在;
故答案为:无水硫酸铜;水;
(6)二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳的存在;
故答案为:澄清的石灰水; CO2.
点评 本题考查了反应产物判断,明确浓硫酸的性质及反应生成二氧化硫、二氧化碳、水的性质是解题关键,注意实验设计的严密性,侧重考查学生分析实验、解决问题的能量,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3COONa固体 | B. | Na2SO4固体 | C. | 少量NH4HSO4固体 | D. | NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2 | B. | 1:1:1 | C. | 5:5:4 | D. | 7:7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向酸性KlO3溶液中加入KI溶液:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeS除去污水中的微量Hg2+:FeS+Hg2+═HgS+Fe2+ | |
| C. | NaHCO3溶液呈碱性:HCO3-+H2O?CO32--+H3O+ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com