
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
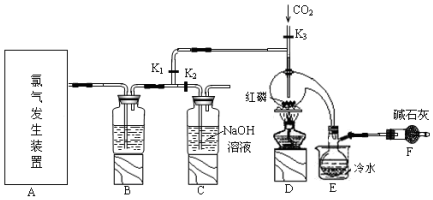
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(1)实验前玻璃管之间连接需要用到橡皮管,其连接方法是先用水润湿玻璃管口;
(2)氯气为酸性气体,需用酸性干燥剂干燥,吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,红磷在温度较高的条件下能自燃,通入二氧化碳赶净空气,通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;先关闭K1,打开K2,利用氯气排净装置中的空气;
(4)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷;
(5)通过滴定原理测定混合物中PCl3的质量分数,可借助于原子守恒并结合关系式PCl3~H3PO3~I2,2Na2S2O3~I2进行计算.
解答 解:(1)实验前玻璃管之间连接需要用到橡皮管,其连接方法是先用水润湿玻璃管口,然后稍稍用力即可把玻璃管插入橡皮管中,
故答案为:玻璃管口用水润湿;
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应
故答案为:浓硫酸;吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1,关闭K2,
故答案为:排尽装置中的空气,防止红磷与空气中的氧气发生自燃;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏;
(5)滴定实验涉及关系式为PCl3~H3PO3~I2和2Na2S2O3~I2,设混合物中PC13的物质的量为nmol,水解生成的H3PO3反应掉的I2的物质的量为nmol;滴定多余I2的消耗的Na2S2O3的物质的量为0.1000mol•L-1×8.40×10-3L=8.4×10-4mol,多余的I2的物质的量为$\frac{0.0008mol}{2}$=0.0004mol,提供I2的总物质的量为0.1000mol•L-1×10.0×10-3L=1.0×10-3mol,则H3PO3反应掉的I2的物质的量nmol=1.0×10-3mol-0.0004mol=0.0006mol,25ml溶液里含有PC13的质量为0.0006mol×137.5g•mol-1=0.0825g,产品中PC13的质量分数为$\frac{0.0825g}{1g×\frac{25}{250}}$×100%=82.5%,
故答案为:82.5%.
点评 本题考查阅读获取信息的能力、对实验原理理解等,题目难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离乙酸乙酯和水 | |
| D. | 淀粉溶液与硫酸共热后,加入新制氢氧化铜加热,无砖红色沉淀生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
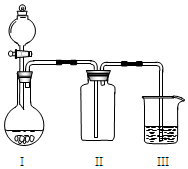 实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和表中提供的物质完成相关实验,其中合理的选项是( )
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和表中提供的物质完成相关实验,其中合理的选项是( )| 选项 | I中的物质 | II中收集的气体 | III中的物质 |
| A | Cu和浓硝酸 | NO | NaOH溶液 |
| B | 浓盐酸和高锰酸钾 | Cl2 | NaOH溶液 |
| C | 大理石和稀硫酸 | CO2 | 澄清石灰水 |
| D | 浓氨水和CaO | NH3 | 滴加酚酞的水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: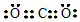 | B. | 聚丙烯的结构简式: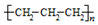 | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | 镁离子的结构示意图: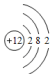 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.l mol•L-1CH3COOH溶液的pH=3,则CH3COOH的电离平衡常数约为10-5 | |
| B. | 常温下,pH=7的溶液中,K+、NH4+、NO3-、CH3COO-能大量共存 | |
| C. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu | |
| D. | 向Fe(OH)3胶体中逐滴加入盐酸,可观察到先生成红褐色沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO2中磷元素的化合价为+1 | |
| B. | H3PO2的电离方程式为H3PO2?H++H2 PO2- | |
| C. | H3PO2被AgNO3氧化成了H3PO4 | |
| D. | NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2→H+H的过程需要吸收热量 | |
| B. | 若生成2mol水蒸气,则放出的能量大于566 kJ | |
| C. | 2g氢气完全燃烧生成液态水所释放的能量为283kJ | |
| D. | 2mol氢气与1mol氧气的能量之和大于2mol液态水的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
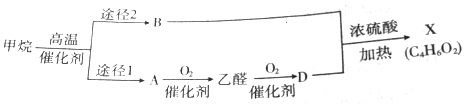
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com