
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离乙酸乙酯和水 | |
| D. | 淀粉溶液与硫酸共热后,加入新制氢氧化铜加热,无砖红色沉淀生成,说明淀粉没有水解 |
分析 A.转移液体,玻璃棒引流,且下端在刻度线下;
B.pH试纸不能湿润;
C.乙酸乙酯和水分层;
D.水解后检验葡萄糖,应在碱性条件下.
解答 解:A.转移液体,玻璃棒引流,且下端在刻度线下,操作合理,故A正确;
B.pH试纸不能湿润,否则测定醋酸的pH偏大,故B错误;
C.乙酸乙酯和水分层,应选分液漏斗分离,故C错误;
D.水解后检验葡萄糖,应在碱性条件下,没有加碱至碱性,再加入新制氢氧化铜加热,不能检验,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验操作、pH测定、混合物分离、有机物性质为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.5mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa固体 | B. | Na2SO4固体 | C. | 少量NH4HSO4固体 | D. | NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 用光束照射该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中分散质为Fe2O3 | |
| D. | 分散系为胶体,胶粒直径即Fe(OH)3分子直径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA | |
| B. | 常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA | |
| C. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去 CO2中混有的 CO,通入 O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2 (OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去 FeCl3 溶液中的 FeCl2 杂质,加入足量铁粉,再过滤即可 | |
| D. | 除去 Al2O3的 MgO 加入足量的稀盐酸,再过滤即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
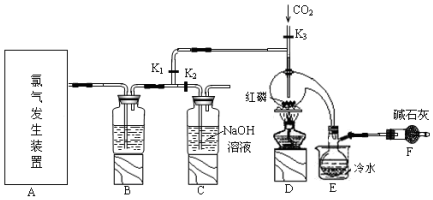
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com