
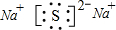 ,故答案为:
,故答案为: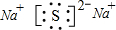 ;
;

科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:

(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。

查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市高三第三次模拟考试(理综)化学部分 题型:填空题
X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)XY2分子的空间构型为 。
(2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是 。
(3)晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___ 。

(5)氧化物MO的电子总数与QX的相等,则M为 。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 ,X2Y2的电子式 ,Z2Y2与X2Y反应的化学方程式是 .
(2)如图所示装置,两玻璃管中盛满滴有酚酞的ZW的饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体聚集。此时C(I)为 极,电极反应式为 。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2电流表的指针发生偏转。此时C(II)为 极, 电极反应式为 。

(3)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是: 。若该方程式同时为一套原电池装置的总反应式,则该原电池负极反应式为 ,正极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08福州八中质检)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 ,X2Y2的电子式 ,Z2Y2与X2Y反应的化学方程式是 .
(2)如右图所示装置,两玻璃管中盛满滴有酚酞的
ZW的饱和溶液,C(I)、C(II)为多孔石墨电极。
接通S1后,C(I)附近溶液变红,两玻璃管中有
气体聚集。此时C(I)为 极,电极反应式为
。
一段时间后(两玻璃管中液面未脱离电极),断
开S1,接通S2电流表的指针发生偏转。此时
C(II)为 极, 电极反应式为
。
(3)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入
X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
。若该方程式同时为一套原电池装置的总
反应式,则该原电池负极反应式为 ,正极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期元素,其原子序数依次增大。原子半径关系按 X、Y、Z 、W依次减小。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。
(1)X位于元素周期表中第 周期第 族;X和W形成含有非极性键化合物的电子式 。
(2)X的单质和Y的单质相比,熔点较高的是 (写名称);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 。
(4)在25?C、101 kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com