
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:

(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。

(1)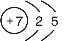 (2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(3)Al3++3H2O Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
(5)2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1(3分) (6)<(1分)?? 75%(3分)
【解析】
试题分析:根据短周期元素X、Y、Z、W在元素周期表中相对位置可知,X位于第二周期,Y、Z、W位于第三周期。其中Y所处的周期序数与族序数相等,所以Y是第三周期第ⅢA族元素,即Y是铝,则Z是Si,X是N,W是Cl。
(1)氮元素的原子序数是7,则氮元素的原子结构示意图为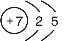 。
。
(2)判断非金属性强弱的一般规律是:①由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。②由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。③由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。④由和氢气化合的难易程度判断:化合越容易,非金属性越强。⑤由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)。⑥由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。⑦由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕。⑧按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。⑨非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。因此可以根据高氯酸能制备硅酸来验证W非金属性强于Z,反应的化学方程式为2HClO4+Na2SiO3=2NaClO4+H2SiO3↓。
(3)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,胶体具有吸附性,因此明矾可以作净水剂,反应的离子方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(4)原电池中负极失去电子,发生氧化反应。所以根据反应式Si+2NaOH+H2O=Na2SiO3+2H2可知,如果利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),则硅是负极,因此该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O。
(5)已知:①C(s)+ O2(g)=CO2(g)? △H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g) △H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)? △H=c kJ· mol-1,则根据盖斯定律可知①+②-③即得到工业上生产粗硅的热化学方程式,即为2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1。
(6)根据表中数据可知,随着温度的升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0;设CO和H2O起始浓度分别为a,则
???????????? CO(g)+H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度??? a????? a????????? 0??????? 0
转化浓度??? b????? b????????? b??????? b
平衡浓度? a-b??? a-b??????? b??????? b
所以根据平衡常数表达式可知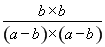 =9
=9
解得b=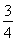 a
a
所以CO平衡转化率为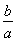 ×100%=75%
×100%=75%
考点:考查元素推断、非金属性强弱比较、盖斯定律应用、原电池应用以及可逆反应的有关判断与计算


科目:高中化学 来源: 题型:



| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原高考资源网子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如下图所示转化(部分产物已略去):
(1)Y在周期表的位置是______________________;Z2的结构式是________。
(2)反应①的离子方程式____________________________________________。
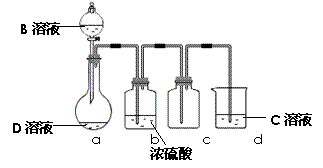 (3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。
I、写出反应②的离子方程式_____________________
II、上述实验装置不够完善,改进方法是
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com