
| X | ||
| Y | Z |
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
| 1×x |
| 1×3 |
| 1×x |
| 1×3 |
| 1×5 |
| 1×3 |
| (1-a)×(5-a) |
| (1+a)×(3+a) |


科目:高中化学 来源: 题型:



| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:

(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原高考资源网子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如下图所示转化(部分产物已略去):
(1)Y在周期表的位置是______________________;Z2的结构式是________。
(2)反应①的离子方程式____________________________________________。
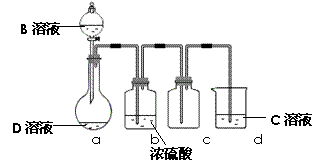 (3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如右图所示(夹持固定装置的仪器已略去)。
I、写出反应②的离子方程式_____________________
II、上述实验装置不够完善,改进方法是
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com