
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(2)根据速率之比等于化学计量数之比计算;
(3)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(4)列出三段式,根据平衡常数计算;
解答 解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数k=$\frac{[CO]{\;}^{6}}{[{N}_{2}]{\;}^{2}}$;
故答案为:$\frac{[CO]{\;}^{6}}{[{N}_{2}]{\;}^{2}}$;
(2)已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为:v(N2)=$\frac{1}{3}$v(CO)=$\frac{1}{3}$×18mol/(L•min)=6mol/(L•min);
故答案为:6;
(3)A.单位时间内1.2molSi-O断裂的同时有0.2molN≡N断裂,都表示的正方向速率,不能作为判断达到平衡的标志,故A选;
B.反应正向进行Si3N4的质量增加,逆向进行质量减小,达到平衡时质量不变,所以可以作为判断依据,故B不选;
C.ν(CO):ν(N2)=3:1,为同一方向速率关系,不能表明V正=V逆,不能作为判断达到平衡的标志,故C选;
D.反应正向进行,N2的转化率增大,逆向进行氮气转化率降低,所以可以作为判断依据,故D不选;
故选:AC;
(4)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g)$\stackrel{高温}{?}$Si3N4(s)+6CO(g)
起始:2mol 0
转化:x 3x
平衡:2-x 3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:$\frac{(3x){\;}^{6}}{(2-x){\;}^{2}}$=729,解之得x=1,
则N2的转化率是$\frac{1}{2}$=50%,
故答案为:50%.
点评 本题考查了化学平衡知识,侧重考查化学平衡常数表达式的书写及有关计算,化学平衡判断,明确化学平衡特征及三段式的应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
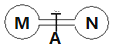 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | NH3 | HI | NO |
| 气体N | SO2 | HCl | Cl2 | O2 |
| A. | ③=④>①>② | B. | ③>④>①>② | C. | ④>③>②>① | D. | ④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com